ФИБРИН
ФИБРИН
(латинский fibra волокно) — нерастворимый в воде белок, образующийся из фибриногена при действии на него тромбина в процессе свертывания крови. Кровяной фибриновый сгусток, останавливающий кровотечение, состоит из сплетенных в густую сеть нитей фибрина и захваченных ими форменных элементов крови.
Фибрин образуется из растворенного в плазме крови фибриногена (см.) при действии протеолитического фермента тромбина (см.).
Биологическая роль фибрина заключается в осуществлении гемостаза (см.), защите раневых поверхностей от возбудителей инфекции путем образования фибринового барьера; фибрин участвует также в репарации соединительной ткани и в воспалительных процессах (см. Воспаление). Нарушение фибринообразования или качественная неполноценность фибрина приводят к расстройствам гемостаза, к появлению геморрагических диатезов (см.).
Превращение фибриногена в фибрин происходит при нарушении целостности кровеносных сосудов или при патологическом внутрисосудистом свертывании крови (возможно, в кровяном русле происходит постоянное образование фибрина). Этот процесс включает три стадии. В первой стадии тромбин вызывает отщепление от фибриногена фибриноиептида А (мол. вес 2000), затем фибриноиептида В (молекулярный вес 2400). Оставшаяся часть молекулы фибриногена носит название фибрин-мономера. Во второй стадии происходит спонтанная полимеризация фибрин-мономеров в фибрин-полимеры, последние имеют вид белковых нитей, в которых молекулы фибрин-мономеров соединены водородными связями, образованными между остатками аминокислот тирозина (см.) и гистидина (см.). Полимеризация (см.) осуществляется постепенно через образование димеров, тримеров и т. д. Эта стадия происходит без участия тромбина и, согласно теории В. А. Белицера и сотр., в ее основе лежит программа самосборки фибрин-мономеров специфическими функциональными центрами. При этом происходит изменение формы молекул фибрина из глобулярной в фибриллярную. По мере образования пучков протофибрилл формируется поперечная исчерченность молекул фибрина
В третьей стадии под влиянием фермента, называемого фибринста-билизирующим, или XIII фактором свертывания крови, в присутствии ионов Са2г происходит связывание фибрин-полимеров ковалентными связями. Фактор XIII вызывает реакцию переноса амидной группы с образованием пептидной связи между остатком глутамина одной молекулы белка и остатком лизина другой. Реакции третьей стадии вызывают стабилизацию белка, или образование поперечных связей между полимерами фибрина, и ведут к образованию в фибрине сначала димеров 7-цепей, а затем полимеров а-цепей. Стабилизация улучшает гемостатические свойства фибрина в результате увеличения механической прочности и эластичности сгустка фибрина уменьшения его чувствительности к протеолизу и повышения роли в репарации тканей. Оптимальной температурой для полимеризации фибрина является температура 37° при pH от 6,9 до 7,4. Подкисление раствора до pH 5,1—5,3 нарушает полимеризацию при повышении значения pH до 5,7 — 6,1 происходит спонтанная полимеризация. Сдвиги pH в сторону нейтральной или слабощелочной реакции способствуют образованию фибринового сгустка. Скорость образования фибрина более или менее постоянна при 30—40°. При повышении температуры до 50° фибрин не образуется вследствие необратимой денатурации фибриногена. Кроме тромбина, образование фибрина вызывают протеазы змеиных ядов (см.) — рептилаза, арвин (анкрод), дефибраза и др: При этом образуется неполноценный фибрин, так как протеазы змеиных ядов отщепляют от молекулы фибриногена только пептид А или пептид В и не активируют фактор XIII.
Молекула фибрина так же как фибриногена состоит из трех типов полипептидных цепей, обозначаемых а, |3 и у и отличающихся от него отсутствием фибринопептидов А и В в а- и (3-цепях. Формулу стабилизированного фибрина представляют как (аР, (3, у2), где аР обозначает полимеры а-цепей, у2— димеры у-цепей. Фибрин не растворим в солевых растворах, в щелочах и кислотах.
Фибриновый сгусток, образующийся в естественных условиях при свертывании крови, включает сыворотку крови и форменные элементы, он обладает способностью адсорбировать на своей поверхности и инактивировать значительные количества тромбина и X фактора свертывания крови. Фибрин, полученный из 1 мг фибриногена, адсорбирует до 2000 ЕД тромбина. В связи с этим фибрин обозначается как антитромбин I.
Сгустки фибрина подвергаются ретракции и лизису. Протеолитическое расщепление фибрина вызывается рядом протеаз, в том числе трипсином (см.), расщепляющим до 360 связей в молекуле фибрина Специфичная для фибрина протеаза фибринолизин (см.) расщепляет в его молекуле до 160—180 пептидных связей, в результате чего образуются четыре основные продукта расщепления — фрагменты X, Y, D и Е; из них для стабилизированного фибрина характерен только фрагмент D, который в отличие от фрагмента D фибриногена имеет форму димера, содержащего ковалентно связанные у-цепи.
Фибрин в тканях и органах обнаруживают методами электронной микроскопии и окраской эозином и гематоксилином Маллори (см. Маллори методы) и по Вейгерту (см. Вейгерта методы окраски). Фибрин в плазме крови определяют методом Рутберга. При этом к 1 мл плазмы крови добавляют 0,1 мл 5% раствора хлорида кальция, образовавшийся сгусток фибрина извлекают и просушивают на фильтровальной бумаге до так называемого суховоздушного состояния, затем взвешивают.
В клинической практике препараты фибрина используют в виде фибринной губки или пленки (см. Фибрипная губка, пленка) для заживления ран и остановки кровотечения (см.).
Библиогр.: Андреенко Г. В. Фиб-ринолиз. (Биохимия, физиология, патология), М., 1979; Белиц ер В. А.Домены — крупные функционально важные блоки молекул фибриногена н фибрина, в кн.: Биохимия животных и человека, под ред. М. Д. Курского, в. 6, с. 38, Киев, 1982; 3 у б а и р о в Д. М. Биохимия свертывания крови, М., 1978; Кудряшов Б. А. Биологические проблемы регуляции жидкого состояния крови и ее свертывания, М., 1975; Human blood coagulation, haemostasis and thrombosis, ed. by Б. Biggs, Oxford a. o., 1972; Per1 i с k E. Gerinnungslaboratorium in Kli-nik und Praxis, Lpz., 1971. См. также библиогр. к ст. Свертывающая система крови.
Г. В. Андреенко.
Тромбоцит — обогащенный фибрин для армированного восстановления костной ткани
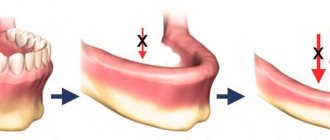
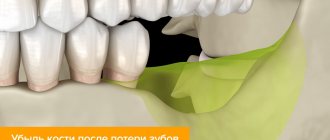
Восстановление костной ткани при краевой аугментации становится все более важной процедурой последние годы. Это связано с тем, что мы желаем достигать максимально эстетичные результаты у наших пациентов с утраченными зубами. Иногда костные дефекты весьма объемные и поэтому требуют большого количества материала для подсадки. Такие клинические ситуации требуют применения костных блоков или костного материала на титановой пластине, а также недавно разработанные продукты, содержащие костные протеины (BMP), которые чаще называют ростовыми факторами. Титановые пластины помогают избежать сложного второго хирургического доступа, необходимого при блоках аутоткани, при этом являясь экономически весьма разумным решением по сравнению с продуктами ростовых факторов, таких как INFUSE (Medtronix). Такая процедура регенерации костной ткани требует ушитие лоскута без натяжения и хорошего изначального закрытия, так как даже при хорошей шовной технике и адекватном раскрытии надкостницы, наиболее частое осложнение – это отслойка лоскута и обнажение трансплантата. После того как хирургическая рана открывается, а пластина оказывается обнаженной, происходит контаминация трансплантата, что приводит к частичной или полной потере материала.
Фокусирование на ростовых факторах
Ростовые факторы последнее время находились под пристальным вниманием многих техник тканевой регенерации, конкретно в применении аутоконцентратов крови, например тромбоцитарно-обогащенной плазмы, тромбоцитарно-обогащенных ростовых факторов и тромбоцитарно-обогащенном фибрине (PRF).
PRF мембрана содержит большое количество факторов роста. Они синтезируются мегакариоцитами и хранятся в основном в альфа-гранулах тромбоцитов. После того, как тромбоциты активируются в зонах повреждения тканей, они секретируют протеины, такие как фибриноген, фибронектин, витронектин, ростовые факторы, включая BMP, ростовой фактор – бетта, тромбоцитарный ростовой фактор, инсулиноподобный ростовой фактор, сосудисто-эндотелиальный ростовой фактор, ростовой фактор фибробластов и невероятно важный коагуляционный глиикопротеин тромбоспондин-1 в течение 7 дней. Фибриновая мембрана также обеспечивает отличную основу для эпителизации, а высокая концентрация ростовых факторов и высвобождение цитокинов стимулирует процесс заживления путем микроваскуляризации и роста новых тканей.
Я видел хорошие результаты регенерации костной ткани с применением PRF мембран, в то время как процедура аугментации с титановой пластиной привела к отслойке лоскута на раннем этапе, тогда было решено применить PRF мембрану для стимуляции закрытия мягких тканей поверх обнажившейся пластины. Данная статья описывает краевую аугментацию, в которой на раннем этапе произошло обнажение пластины, а также этапы по коррекции данного осложнения.
Клинический случай
Диагностика и план лечения
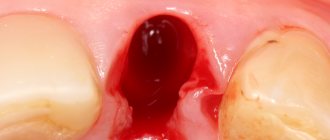
В клинику обратилась здоровая 30-летняя женщина с крупным дефектом альвеолярного гребня в зоне верхнего правого первого премоляра, образовавшегося после удаления инфицированного зуба (Фото 1). При восстановлении дефекта зубного ряда протезом или имплантатом без коррекции костного края возможны неудачи в эстетическом плане.
Фото 1: Фотография недостаточного альвеолярного гребня
Прицельный рентгеновский снимок показывает двухмерный вид места экстракции и недостаточную высоту костного гребня (Фото 2).
Фото 2: Рентгенограмма недостаточного альвеолярного гребня
Спиральная томография также была проведена для тщательного планирования лечения. На снимке заметна костная ткань высотой 5,5 мм до дна гайморовой пазухи и шириной менее 3 мм по гребню (Фото 3).
Фото 3: КТ недостаточного альвеолярного гребня
Клинический протокол
Проведена подсадка трансплантата после отслаивания полного мукопериостального лоскута, создавая множественные кортикальные перфорации (Фото 4) для вызова феномена региональной акселерации. Использована титановая пластина с костной массой NovaBone (ACE Surgical) (Фото 5). Титановая пластина стабилизирована тремя титановыми шурупами (MiniPlate Impladent) (Фото 6) и лоскут был ушит Cytoplast Polytetrafluoroethylene (PTFE) нитью (Osteogenics Biomedical) (Фото 7). Рентгенограмма после хирургического вмешательства показала, что трансплантат костной ткани был хорошо фиксирован на титановой пластине, закрепленной тремя шурупами (Фото 8).
Фото 4: Лоскут и кортикальные перфорации
Фото 5: Костная масса на титановой пластине
Фото 6: Фиксация титановой пластины шурупами
Фото 7: Ушитие лоскута
Фото 8: Рентгенограмма после операции
Неделю спустя после вмешательства, на контрольном посещении, рана имела признаки легкого раскрытия по швам (Фото 9) и через две недели, в месте операции появилась обнаженная титановая пластина.
Фото 9: Раннее расхождение швов
Пациенту было рекомендовано осуществлять полоскания раствором хлоргексидина (Peridex 3M ESPE) дважды в день, а также еженедельно являться для осмотра. Три недели спустя после операции пластина все больше обнажалась с образованием окна в 5 мм, признаки воспаления и инфицирования отсутствовали (Фото 10).
Фото 10: Обнажение пластины спустя три недели
Пациент был предупрежден о риске отторжения трансплантата и согласился на восстановительную терапию PRF. Зона анестезирована, и ткани вокруг обнаженной пластины освежены скальпелем. Под образовавшиеся края введены PRF мембраны, а затем рана ушита PTFE швами (Фото 11).
Фото 11: Обнаженную пластину закрыли тромбоцит обогащенным фибрином (PRF)
Полное закрытие титановой пластины произошло спустя 2 недели (Фото 12).
Фото 12: Полное закрытие пластины после лечения PRF
Заключительный комментарий
Полученные результаты показывают эффективность PRF мембран при стимулировании эпителизации, а ростовые факторы индуцируют быстрый рост тканей и заживление. По мнению авторов, это один из множества способов применения PRF в ежедневной стоматологической практике.
Автор: Carlos Boudet, DDS