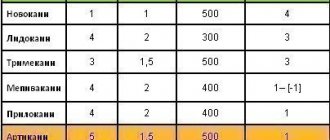
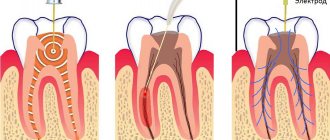
Постановка правильного диагноза при клиническом обследовании стоматологического больного, является необходимым условием для успешного лечения больного.
Такие методы обследования как сбор анамнеза, осмотр, электроодонтодиагностика, температурная диагностика, рентгеновское исследование применяются в стоматологии. Проводятся также лабораторные (общий клинический анализ крови, аллергологические и цитологические и др.) исследования и пробы.
Этапы стоматологического обследования
Больной проходит обследование в три этапа.
- выяснение жалоб и анамнеза заболевания;
- исследование при помощи физических методов (осмотр, пальпация, перкуссия, аускультация);
- исследование при помощи специальных методов (лабораторные, рентгенологические).
Окончательный клинический диагноз ставится после выяснения жалоб и других аспектов болезни, сбора дополнительной информации о больном. Все это позволит на следующем этапе провести соответствующее лечение.
Анализы перед имплантацией
Имплантация зубов, как и любая другая процедура сопряженная с оперативным вмешательством, требует тщательной подготовки. Пренебрежение протоколом вживления имплантата чревато его отторжением и воспалительными процессами. Поэтому важно перед проведением имплантации сдать все необходимые анализы. Это позволит:
- Выявить скрытые проблемы с десневыми тканями;
- Исключить реакцию на наркоз и применение лекарственных препаратов;
- Определить состояние костной ткани пациента;
- Оценить общее состояние пациента перед операцией.
Полный список анализов, которые могут быть назначены дантистом перед вживлением импланта:
- Клинический общий анализ крови;
- Анализ на уровень глюкозы в сыворотке крови пациента;
- Анализ на сифилис RPR HBsAg;
- АЧТВ;
- Анализ на фибриноген;
- Определение на протромбин;
- МНО;
- Определение на Антитромбин III;
- Анализ тромбинового времени;
- Определение наличия антител к ВИЧ 1 и 2;
- Определение наличия антигена ВИЧ 1 и 2;
- Качественный тест Anti-HCV-total;
- Анализ мочи на содержание протеина и креатинина.
Анализы при пародонтозе
Пародонтоз является крайне опасным заболеванием, которое носит выраженный системно-дистрофический характер по отношению к тканям пародонта. Часто для избавления от недуга необходимо совместная диагностика и составление плана лечение специалистов нескольких направлений – стоматолога общей практики, пародонтолога, терапевта. Поэтому в процессе подготовки к терапии врач может назначить максимально широкий список лабораторных анализов. Результаты исследования позволяют выявить какая система организма пациента ослабла, что привело к развитию пародонтоза.
Болевой симптом
Болевой симптом является важным показателем для постановки диагноза. Путем выяснения жалоб происходит расспрос больного. Врач-стоматолог определяет причины возникновения боли, ее характер (пульсирующие, дергающие, ноющие болевые ощущения), время появления (в ночное время или днем), продолжительность (постоянные или приступами), места возникновения болей.
Вся эта информация ложиться в основу постановки диагноза. Устанавливается время существования симптомов, формируется динамика патологического процесса. После этого необходимо собрать информацию о проводимом лечении. Было ли оно проведено и если да то насколько результативным оно было. Больной опрашивается на предмет перенесенных заболеваний, аллергологический и эпидемиологический анамнез, условия труда.
Объективное стоматологическое (и не только) обследование состоит из осмотра, пальпации (основные методы), перкуссия и ряд дополнительных методов.
Инфекционно-воспалительные заболевания пародонта в полной мере можно назвать болезнями цивилизации, если учесть, что в списке наиболее частых заболеваний человека им отводится шестое место. Постоянное действие предрасполагающих факторов (социальных, системных, ятрогенных, местных условий полости рта и др.) на фоне неблагополучия окружающей среды чрезвычайно часто приводят к развитию пародонтопатий во всех возрастных группах с увеличением доли поражений средней и тяжелой степени у лиц старше 35 лет. Согласно сообщению ВОЗ (WHO: Oral health. Fact sheet №318, April 2012), современные успехи в понимании этиологии патогенеза, а также в лечении этих заболеваний существенно не изменили положение к лучшему.
Инфекционно-воспалительные заболевания пародонта склонны к хроническому прогредиентному течению, и от своевременности диагностики, раннего начала адекватных лечебных и реабилитационных мероприятий зависит исход патологического процесса. В одном из обзоров U. Carounanidy, R. Sathyanarayanan [14], посвященных проблеме диагностики кариеса как провоцирующего фактора заболеваний пародонта, авторы прокомментировали диаграмму «Кариесный айсберг», предложенную в свое время N. Pitts, C. Longbottom [38], которая довольно четко отражает состояние диагностики этого патологического состояния и основные проблемы, связанные с ней на современном этапе (рис. 1).
Рисунок 1. «Кариесный айсберг» — диагностическая схема, D1-D4 — диагностические критерии [38].
Можно полагать, что данная диаграмма может быть применена к диагностике не только кариеса, но и любой другой стоматологической патологии, при этом авторы так описывают основные этапы становления диагностического процесса:
1) разработка строгих критериев диагностики, основанных на легко выявляемых признаках заболевания;
2) совершенствование техники диагностических методов, направленных на снижение их диагностического порога при верификации диагноза на качественном уровне;
3) разработка методов количественной оценки патологических состояний для распознавания «скрытых» отклонений, не регистрируемых на качественном уровне;
4) переход от логически построенной, номинальной или порядковой шкалы оценки патологического процесса к числовой шкале, позволяющей осуществлять мониторинг заболевания и прогноз его течения и исходов [14].
Представленная схема отчетливо демонстрирует, что начиная со второго этапа у врача-стоматолога возникает насущная необходимость не ограничиваться клиническими методами обследования больного, а прибегать к инструментальной и лабораторной диагностике. Так, если на первом этапе основу диагностики составляет принцип клинического наблюдения, то на втором этапе необходим иной уровень оценки данных, который требует научной разработки перечня биологических маркеров заболевания и наличия в арсенале лабораторной диагностики способов их регистрации. На третьем этапе речь идет о количественной оценке биомаркеров лабораторными методами и научной разработке сопутствующих признаков заболевания — индикаторов, факторов и детерминант риска развития самого заболевания и его неблагоприятных исходов. Наконец, четвертый этап предполагает создание системы диагностического мониторинга с определением предикторов заболевания, его биологических маркеров, критериев оценки его течения, прогноза возможных исходов и эффективности лечебных мероприятий.
С этой точки зрения развитие лабораторных методов и возможность их применения в диагностике стоматологических заболеваний требует не только их технического совершенства, но и учета особенностей патогенеза поражений полости рта, в том числе инфекционно-воспалительного генеза, а это, в свою очередь, является важнейшим шагом к разработке методов патогенетической терапии данных заболеваний [44].
Этиология и патогенез инфекционно-воспалительных заболеваний пародонта
Разработка критериев для лабораторно-диагностического процесса
Современный уровень организации лабораторно-диагностического процесса в стоматологии наглядно можно проследить на примере инфекционно-воспалительных заболеваний пародонта, частота развития которых у взрослых людей достигает 50-70% [3, 45].
Как известно, инфекционно-воспалительный процесс в пародонте чаще всего инициируется вирулентными микроорганизмами пародонтопатогенных видов, одного воздействия которых, по современным представлениям, недостаточно, поскольку для развития и прогрессирования патологического процесса определенное значение имеют особенности реагирования на патогены самого макроорганизма [21, 41]. После запуска инфекционного процесса поражение пародонта, как правило, прогрессирует с потерей волокон коллагена и их связи с цементом зуба, миграцией апикального эпителия, углублением пародонтальных карманов и резорбцией альвеолярной кости [36].
Современные представления о патогенезе развития инфекционно-воспалительных заболеваний пародонта довольно детально описаны в работах [24, 28, 45] и др., а общая схема их развития может выглядеть так, как это показано на рис. 2.
Рисунок 2. Схема патогенеза развития инфекционно-воспалительных заболеваний пародонта.
В соответствии с представленной схемой важнейшим пусковым фактором в инициации патологического процесса является формирование зубной бляшки как многослойной микробной биопленки с участием пародонтопатогенных микроорганизмов [12, 29]. К их числу принадлежат такие возбудители хронического воспалительного процесса в пародонте, как Tanerella forsythensis, Porphyromonas gingivalis, Treponema denticola,
а также индуктор острого агрессивного воспаления
Actinobacillus actinomycetemcomitans
[45, 50]. Все эти пародонтопатогены являются источником липополисахаридов (ЛПС), способных взаимодействовать с клетками поврежденного эпителия, нейтрофильными гранулоцитами, моноцитами/макрофагами, фибробластами через Toll-подобные рецепторы (TLR) [28].
Следует подчеркнуть, что процесс взаимодействия пародонтопатогенов с TLR клеток в значительной мере отличается от такового с участием нормальной микрофлоры биопленок. Так, на модели кариеса было установлено, что представители нормальной микрофлоры в отличие от патогенов индуцируют образование цитокина TФРβ1 (трансформирующий фактор роста β1), который в свою очередь угнетает экспрессию TLR [27]. В отличие от этого сценария при преобладании патогенной микрофлоры через TLR обеспечивается непрерывный поток сигналов, активирующих макрофаги и другие иммунокомпетентные клетки, несущие эти рецепторы [27], и побуждающих их к хемотаксису, секреции провоспалительных цитокинов (фактор некроза опухоли α (ФНОα), интерлейкины (ИЛ)-1, -6, -8), высвобождению матриксных металлопротеиназ и других ферментов, продукции специфичных к микробным антигенам иммуноглобулинов, продуцируемых с участием привлеченных хемокинами Т- и В-лимфоцитов [24, 28, 45, 50]. Высвобождающиеся ферментативные субстанции принимают участие в деградации коллагена и других белков внеклеточного матрикса, в результате чего теряется контакт между пародонтом и костью [3, 24, 45]. Довольно велика роль провоспалительных цитокинов, которые, помимо индукции воспалительных изменений в тканях, способны активировать остеокласты и способствовать таким образом резорбции кости альвеолярных отростков [45].
В результате всех описанных взаимодействий в гингивально-цервикальной жидкости возникает сложный комплекс молекул, включающий электролиты и другие малые молекулы, белки, цитокины, антитела, бактериальные антитела, ферменты, продукты распада соединительной и костной тканей [18, 31, 39, 43]. Все указанные компоненты потенциально могут рассматриваться как биомаркеры инфекционно-воспалительных заболеваний пародонта.
В таблице
представлены основные и вспомогательные биомаркеры инфекционно-воспалительных заболеваний пародонта, используемые в настоящее время для диагностических и исследовательских целей и идентифицируемые при анализе биопленок, гингивально-цервикальной жидкости, слюны.
В наиболее полном виде эти биомаркеры описаны M. Taba и соавт. [45]. При этом M. Curtis, I. Gillett [15] в свое время предложили выделять три категории биомаркеров:
1) показатели текущей активности заболевания;
2) предикторы прогрессирования заболевания;
3) предикторы заболевания у здорового в настоящее время человека.
Среди этих категорий биомаркеров особого внимания заслуживает группа признаков, позволяющих прогнозировать прогрессирование заболевания и отражающих количественные характеристики показателей.
Таким образом, на примере инфекционно-воспалительных заболеваний пародонта отчетливо видно, что техническое совершенствование лабораторного определения биомаркеров, его перевод на уровень количественного тестирования является важнейшей задачей стоматологии, как и любой другой клинической дисциплины, поскольку позволяет не только точно и своевременно поставить диагноз заболевания, но и прогнозировать его прогрессирование, осложнения и исходы. С этой точки зрения современные методы лабораторной диагностики и их возможности заслуживают отдельного обсуждения.
Оптические методы в лабораторной диагностике инфекционно-воспалительных заболеваний полости рта
Среди всего арсенала методов лабораторной диагностики стоматологических заболеваний оптические методы всегда занимали значительное место в силу их доступности и информативности. Недаром гистологическое исследование биоптатов пораженных тканей было и остается «золотым стандартом» диагностики. В последние десятилетия микроскопическая техника претерпела столь значительные изменения, что позволяет говорить о современных способах микроскопического исследования не только как о научном методе, но и как о способе неинвазивной прижизненной диагностики стоматологических заболеваний.
Существует несколько принципов, положенных в основу современных оптических методов, среди которых особое значение в медицине приобрели конфокальная микроскопия и сканирующая микроскопия ионной проводимости. Для исследовательских целей не потеряла своего значения в стоматологии и электронная микроскопия [12].
История создания конфокального микроскопа относится к середине прошлого века, когда в 50-х годах биологам понадобилось увеличить контраст наблюдения меченых флюорохромами объектов в толстых срезах тканей. Для разрешения этой проблемы М. Минский, профессор Массачусетского технологического института в США, предложил использовать для флюоресцентных микроскопов конфокальную схему. Конфокальный микроскоп основан на принципе получения точечного сигнала от флюоресцирующего объекта в толще ткани с помощью лазерного луча. В связи с этим конфокальный микроскоп, имеющий высокий контраст, дает две неоценимые возможности: он позволяет исследовать ткани на клеточном уровне в состоянии физиологической жизнедеятельности, а также оценивать результаты исследования (т.е. клеточной активности) в четырех измерениях — высота, ширина, глубина и время [37].
Эта техника оказалась пригодной не только для изучения препаратов из микроорганизмов или срезов тканей, а c 1980 г. стала применяться для исследований in vivo
[48]. Так, указанным методом стало возможным определение структуры эпителиальных тканей на глубину 0,1-0,5 мм, давая при этом характеристику клеточного состава и микроваскуляризацию тканей пародонта [52]. Особенно эффективным было использование конфокальной микроскопии для изучения механизма формирования биопленок в составе зубной бляшки и идентификации, в частности, пародонтопатогенных микроорганизмов [29].
Принцип сканирующей микроскопии ионной проводимости (СМИП) был предложен в 1989 г. в Калифорнийском университете P. Hansma и соавт. [25] и в настоящее время предназначается для исследования мягких объектов биологической природы, в частности, клеток в нативном состоянии. Принцип работы СМИП основан на использовании в качестве зонда стеклянной микропипетки, регистрирующей ионный ток, протекающий через ее внутреннее отверстие с радиусом около 100-500 нм, что позволяет сканировать поверхность объекта. Используя СМИП, можно получить детальную информацию о функционировании биологических клеток с нанометровым уровнем пространственного разрешения [11].
Метод может быть использован in vivo для изучения особенностей функционирования клеточных мембран [33], для регистрации движения клеток и их контактов, взаимодействия клеток с вирусами и другими микроорганизмами. Несмотря на широкие возможности метода в изучении эпителиальных структур, опыт применения метода в стоматологии пока остается лишь перспективным.
Методы молекулярной биологии в лабораторной диагностике инфекционно-воспалительных заболеваний полости рта
Методы молекулярной биологии в стоматологии включают широкий круг способов оценки качественного и количественного состава микрофлоры полости рта и биомаркеров различных стоматологических заболеваний. К числу наиболее часто используемых методов относится полимеразная цепная реакция (ПЦР).
Метод ПЦР изобрел в 1983 г. американский ученый Кэри Мюллис. Впоследствии он получил за это изобретение Нобелевскую премию. Сущность метода заключается в том, что он имитирует естественную репликацию нуклеиновых кислот и позволяет получать фрагменты последовательности ДНК, характерные для того или иного микроорганизма, в количествах, достаточных для их распознавания.
В соответствии с этим принципом ПЦР клинического образца включает в себя три основных этапа: пробоподготовка (выделение ДНК из клинического материала), циклы амплификации (умножения фрагментов ДНК) и регистрация результатов. В каждом цикле число копий амплифицируемого участка удваивается, за 30-40 циклов происходит накопление коротких специфических фрагментов в количестве, достаточном для их дальнейшего распознавания. Детекция продуктов амплификации осуществляется по-разному: с помощью электрофореза в агарозном геле, или путем гибридизации со специфическим олигонуклеотидным зондом, или с использованием метода масс-спектрометрии и т. д. [9].
ПЦР очень широко используется для обнаружения и идентификации микробных возбудителей, в том числе и пародонтопатогенных микроорганизмов [4, 7, 8, 35], при этом метод позволяет обнаружить возбудитель в биологическом материале даже тогда, когда другие методы оказываются неэффективными. Диагностическая эффективность ПЦР в этом случае значительно возрастает при ее сочетании с культуральным методом диагностики [12].
Помимо микроорганизмов, методом ПЦР можно определять экспрессию генов, регулирующих образование рецепторов или секреторных продуктов в клетке. В последнем случае примером может служить обнаружение в остеокластах альвеолярных отростков генов, регулирующих нарушенный синтез коллагена I типа с образованием телопептидов, при этом детекция соответствующих генов после амплификации осуществляется путем ДНК-гибридизации [28].
Разнообразие приемов ПЦР, опробованных в стоматологии, можно продемонстрировать еще одним примером. Ранее уже отмечалось, что пародонтогенные микроорганизмы могут инициировать выработку провоспалительных цитокинов и ферментных систем при взаимодействии с клетками, осуществляющими врожденный иммунитет, через Toll-подобные рецепторы (TLR) [27]. Уровень экспрессии мРНК генов TLR обычно определяют методом ПЦР в режиме «реального времени», совмещенной с обратной транскрипцией с использованием специфических праймеров. При этом мРНК служит матрицей для образования с помощью обратной транскриптазы комплементарной ДНК (кДНК), а последняя подвергается амплификации с помощью соответствующих праймеров [51].
Определенные перспективы сулит еще одно направление использования ПЦР — установление полиморфизма ряда генов, сопряженных с высокой вероятностью тяжелого течения хронического пародонтита. Речь идет об аллельных вариантах гена ИЛ-1 — IL-1α +4845 и IL-1β +3954, в соответствии с которыми человека можно отнести либо к «благоприятному», либо к «неблагоприятному» генотипу по возможности развития хронического пародонтита и тяжести его течения [42].
Помимо ПЦР, к методам молекулярной биологии, перспективным для стоматологической клинической практики, следует отнести масс-спектрометрию — физический метод исследования вещества путем определения отношения массы заряженных частиц вещества к их заряду (качества) и количества заряженных частиц, образующихся в процессе воздействия на вещество. С помощью метода масс-спектрометрии различных биологических субстратов можно решать одну из важнейших задач медицины — определение маркеров болезней путем выявления белков, измененный уровень экспрессии которых может послужить средством ранней, доклинической диагностики заболеваний [6]. В стоматологии имеется пример проведения протеомных исследований методом масс-спектрометрии для исследования состава биопленок полости рта [30]. Этим методом было определено большинство биомаркеров инфекционно-воспалительных заболеваний пародонта, относящихся к продуктам распада соединительной и костной ткани.
В последние годы изучение протеома слюны как основы общеклинических лабораторных исследований стало занимать значительное место, наряду с исследованиями крови/плазмы, ликвора, мочи [47].
Иммунологические методы в диагностике инфекционно-воспалительных заболеваний полости рта
Для определения молекулярных продуктов деградации соединительной ткани, резорбции костной ткани, провоспалительных цитокинов широко используют методы иммуноанализа, основанные на применении меченых моноклональных антител. Моноклональные антитела — высокоспецифичные антитела, реагирующие, как правило, на одну антигенную детерминанту и получаемые с использованием гибридомных технологий, т.е. путем скрещивания иммуноцитов с клетками плазмоцитомы. Полученные таким образом клетки гибридомы обладают способностью к неограниченной пролиферации и синтезу антител только одной узкой специфичности, соответствующей клональной специфичности исходного иммуноцита [1]. Для использования в методах иммуноанализа моноклональные антитела подвергают мечению, сшивая их с молекулами флюорохрома, радиоактивной меткой, магнитными частицами или ферментом. В последнем случае использование меченых моноклональных антител служит основой иммуноферментного анализа.
Иммуноферментный анализ (ИФА, ELISA) — метод выявления антигенов или антител, основанный на определении комплекса антиген-антитело за счет введения в один из компонентов реакции ферментативной метки с последующей ее детекцией с помощью соответствующего субстрата, изменяющего свою окраску. Основой проведения любого варианта ИФА служит определение продуктов ферментативных реакций при исследовании тестируемых образцов в сравнении с негативными и позитивными контролями. Чаще всего аппаратный вариант ИФА воспроизводится как «сэндвич»-метод. К носителю с иммобилизованными антителами добавляют биологический материал, содержащий анализируемый антиген (микробные молекулы, цитокины, биомаркеры). В процессе инкубации на первой стадии на твердой фазе образуется комплекс антиген-антитело. Затем носитель отмывают от несвязавшихся компонентов и добавляют меченные ферментом специфические антитела. После вторичной инкубации и удаления избытка конъюгата антител с ферментом определяют ферментативную активность носителя, которая пропорциональна начальной концентрации исследуемого антигена. На стадии выявления специфического иммунокомплекса анализируемый антиген оказывается как бы зажатым между молекулами иммобилизованных и меченых антител, что послужило поводом для широкого распространения названия «сэндвич»-метод. Ферментативная реакция (цветная реакция, в которой фермент представлен обычно растительной пероксидазой) проходит в присутствии перекиси водорода и субстрата, представленного неокрашенным соединением, которое в процессе пероксидазной реакции окисляется до окрашенного продукта. Интенсивность окрашивания зависит от количества выявляемого антигена. Результат оценивается спектрофотометрически [5].
Иммуноферментный метод нашел широкое применение практически во всех областях медицины, используется он и в стоматологии, в том числе для определения биомаркеров заболеваний полости рта инфекционно-воспалительной природы. В частности, при заболеваниях периодонта методом ИФА определяют содержание в гингивально-цервикальной жидкости таких биомаркеров, как цитокины [17, 26, 27], протеогликаны [40], пептидные продукты тканевой деструкции [49]. Этот принцип используется в стоматологии и в качестве экспресс-метода диагностирования ВИЧ-инфекции с использованием проб из десневого содержимого [2].
Помимо ферментного принципа мечения антител в медицине широко используется флюоресцентный принцип. Моноклональные антитела, меченные флюорохромами, широко используются для обнаружения микроорганизмов и биомаркеров различных заболеваний в тканях — иммуногистохимический метод, охарактеризованный в разделе оптических методов. Меченные флюорохромами моноклональные антитела к маркерам клеток иммунной системы позволяют определять количественный состав последних в различных биологических образцах, в том числе и из ротовой полости. Индуктором флюоресценции в данном случае чаще всего служат лазерные лучи с различной длиной волны, а метод такой детекции получил название проточной цитофлюориметрии [16]. Проточная цитофлюориметрия как способ количественной характеристики клеточного состава иммунограмм биологических жидкостей, а также факторов бактерицидной активности в ротовой полости нашла свое применение в различных разделах стоматологии, поскольку позволяет работать как с кровью больных, так и со слюной [10, 46] и гингивально-цервикальной жидкостью [27].
Заключение
Таким образом, развитие технологий, положенных в основу современных лабораторных методов, переводит диагностику стоматологических заболеваний на новый методический уровень. Создавая основу для разработки биомаркеров заболеваний полости рта, как было показано на примере заболеваний пародонта инфекционно-воспалительного генеза, современные лабораторные технологии не только открывают широкий простор для выявления признаков патологического процесса, но и позволяют прогнозировать его течение, осложнения, исходы на базе количественного мониторинга.
Клинические исследования
Лабораторные исследования доказали, что регулярное применение профессиональной зубной пасты АСЕПТА РЕМИНЕРАЛИЗАЦИЯ уже через 4 недели улучшило состояние эмали на 64% и снизило чувствительность зубов на 66%.
Источники:
- Отчет по определению/подтверждению профилактических свойств средств индивидуальной гигиены полости рта «АСЕПТА PLUS» Реминерализация врач-исследователь А.А. Леонтьев, зав. кафедрой профилактической стоматологии, д.м.н., профессор С.Б. Улитовский Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова, кафедра профилактической стоматологии
- Клинический опыт применения серии средств «Асепта» Фукс Елена Ивановна ассистент кафедры терапевтической и детской стоматологии Государственное бюджетное образовательное учреждение высшего профессионального образования Рязанский государственный медицинский университет имени академика И.П. Павлова Министерства здравоохранения и социального развития Российской Федерации (ГБОУ ВПО РязГМУ Минздравсоцразвития России)
- Клинические исследования антисенситивной зубной пасты «Асепта Сенситив» ( А.А. Леонтьев, О.В. Калинина, С.Б. Улитовский ) А.А. ЛЕОНТЬЕВ, врач-стоматолог О.В. КАЛИНИНА, врач-стоматолог С.Б. УЛИТОВСКИЙ, д.м.н., проф. Кафедра терапевтической стоматологии СПбГМУ им. акад. И.П. Павлова
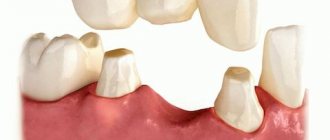
Частично-съемные протезы
Частичные съемные протезы изготавливаются на часть беззубой челюсти и фиксируются незаметными крючками-кламмерами. После каждого приема пищи протез нужно извлечь и ополоснуть проточной водой.
Некоторым людям непросто привыкнуть к съемным зубным протезам, однако если следовать советам, которые можно найти по этой ссылке, процесс привыкания проходит намного проще. Главным преимуществом съемного протезирования является то, что для того, чтобы снять или надеть протез не требуется обращаться в стоматологию, процесс чистки и ухода за конструкцией становится проще.
В стоматологической клинике «Консилиум Дент» всю работу по подбору, изготовлению и установке протезов выполняют опытные стоматологи-ортопеды, которые способны решать самые сложные клинические задачи.
При обращении в клинику, наши врачи в тот же день изготовят временные протезы, которые можно будет использовать до окончания лечения. Это обеспечит нашим пациентам максимальный комфорт и позволит скрыть эстетические недостатки.
Съемные зубные протезы
Съёмные протезы — это конструкции, которые возможно самостоятельно снять и установить. Современные протезы отличает удобство при ношении и привлекательный внешний вид, неотличимый от настоящих зубов.
К съемным конструкциям относят две разновидности: бюгельные и пластиночные.
По способу фиксации различают протезы:
- С кламмерной системой фиксации (кламмер – представляет собой своеобразную форму крючка);
- С фиксацией на аттачментах (на замках и шарнирах);
- С телескопической системой фиксации.