Фармакодинамика
Противогрибковое средство. Производное триазола, проявляет противогрибковый эффект за счет блокады биосинтеза эргостерола клеточной мембраны грибов. «Мишень» для действия препарата — фермент 14-α-деметилаза.
14-α-деметилаза входит в группу ферментов, известных под общим названием цитохром Р450. Все ферменты группы цитохрома Р450 содержат гематиновый железосодержащий пигмент. Флуконазол связывается с атомом железа гематиновой группы и инактивирует 14-α-деметилазу, что приводит к нарушению синтеза эргостерола и накоплению ланостерола и других стеролов. Их включение в мембрану вместо эргостерола значительно нарушает структуру и функцию клеточной мембраны грибов.
Снижение синтеза эргостерола, а также накопление 14α-метилстеролов разрушает плотно упакованные ацильные цепи фосфолипидов мембран грибов. Дестабилизация грибковой мембраны приводит к дисфункции мембранных ферментов, в том числе участвующих в цепи транспорта электронов, и в конечном итоге к гибели клеток.
Применяют при системных микозах: кандидамикозе, криптококкозе, бластомикозе, гистоплазмозе, кокцидиоидомикозе, а также при дерматомикозах. Относительно низкий токсический профиль и высокая степень проникновения в спинномозговую жидкость делают флуконазол препаратом выбора при системном кандидозе и криптококковом менингите. Вследствие осложнений, связанных с интратекальным введением амфотерицина B, флуконазол — препарат первого ряда при кокцидиоидовом менингите. Хотя флуконазол и активен в отношении возбудителей бластомикоза, гистоплазмоза, споротрихоза, он уступает по эффективности в отношении возбудителей этих инфекций итраконазолу. Флуконазол неэффективен при аспергиллезе.
Фармакокинетика
После приема внутрь флуконазол хорошо всасывается, прием пищи не влияет на скорость всасывания флуконазол а, его биодоступность — 90%.
Время максимальной концентрации после приема внутрь, натощак 150 мг препарата 0,5-1,5 ч и составляет 90% от концентрации в плазме при внутривенном введении в дозе 2,5-3,5 мг/л. Период полувыведения флуконазола составляет 30 ч. Связь с белками плазмы 11-12%. Концентрация в плазме находится в прямой зависимости от дозы. 90% уровень равновесной концентрации достигается к 4-5 дню лечения препаратом (при приеме 1 раз/сут).
Введение «ударной» дозы (в первый день), в 2 раза превышающей обычную суточную дозу, позволяет достичь уровня концентрации, соответствующий 90% равновесной концентрации, ко второму дню.
Флуконазол хорошо проникает во все биологические жидкости организма. Концентрация активного вещества в грудном молоке, суставной жидкости, слюне, мокроте и перитонеальной жидкости аналогична таковой в плазме крови. Постоянные значения в вагинальном секрете достигаются через 8 ч после приема внутрь и удерживаются на этом уровне не менее 24 ч.
Фармакокинетика флуконазола существенно зависит от функционального состояния почек, при этом существует обратная зависимость между периодом полувыведения и клиренсом креатинина. После гемодиализа в течение 3 ч концентрация флуконазола в плазме снижается на 50%.
Флуконазол ШТАДА (капсулы): инструкция по применению, состав, цены в аптеках, где купить
Одновременное применение флуконазола со следующими препаратами противопоказано:
Амиодарон.
Совместное применение флуконазола и амиодарона может привести к ингибированию метаболизма амиодарона. Применение амиодарона ассоциировалось с удлинением интервала QT. Одновременное применение флуконазола и амиодарона противопоказано (см. раздел «Противопоказания»).
Астемизол.
Одновременное применение флуконазола с астемизолом или другими препаратами, метаболизм которых осуществляется системой цитохрома Р450, может сопровождаться повышением сывороточных концентраций этих средств. Повышенные концентрации астемизола в плазме крови могут приводить к удлинению интервала QT и в некоторых случаях к развитию аритмии желудочковой тахисистолической типа «пируэт» (torsades de pointes). Одновременное применение флуконазола и астемизола противопоказано.
Пимозид.
Несмотря на то, что не проводилось соответствующих исследований in vitro или in vivo, одновременное применение флуконазола и пимозида может приводить к угнетению метаболизма пимозида. В свою очередь повышение плазменных концентраций пимозида может приводить к удлинению интервала QT и в некоторых случаях развитию аритмии желудочковой тахисистолической типа «пируэт» (torsades de pointеs). Одновременное применение флуконазола и пимозида противопоказано.
Терфенадин.
Одновременное применение азольных противогрибковых средств и терфенадина может приводить к значительному увеличению концентрации терфенадина в плазме: возможно возникновение серьезных аритмий в результате увеличения интервала QT. Одновременное применение флуконазола в дозе 400 мг/сут и более и терфенадина противопоказано.
Хинидин.
Несмотря на то, что не проводилось соответствующих исследований in vitro или in vivo, одновременное применение флуконазола и хинидина может приводить к угнетению метаболизма хинидина. Применение хинидина связано с удлинением интервала QT и в некоторых случаях с развитием аритмии желудочковой тахисистолической типа «пируэт» (torsades de pointеs). Одновременное применение флуконазола и хинидина противопоказано.
Цизаприд.
При одновременном применении флуконазола и цизаприда концентрация цизаприда в плазме может значительно увеличиваться; описаны случаи нежелательных реакций со стороны сердца, в т.ч. мерцание/трепетание желудочков включая (torsades de pointes), увеличение интервала QT на электрокардиограмме (ЭКГ). Одновременное применение флуконазола и цизаприда противопоказано.
Эритромицин.
Одновременное применение флуконазола и эритромицина потенциально приводит к повышенному риску развития кардиотоксичности (удлинение интервала QT, torsades de pointеs) и, вследствие этого, внезапной сердечной смерти.
Одновременное применение флуконазола и эритромицина противопоказано.
Следует соблюдать осторожность и, возможно, корректировать дозы при одновременном применении следующих препаратов и флуконазола:
Препараты, влияющие на флуконазол:
Гидрохлоротиазид.
Одновременное применение флуконазола и гидрохлоротиазида может привести к возрастанию концентрации флуконазола в плазме на 40 %. Эффект такой степени выраженности не требует изменения режима дозирования флуконазола у пациентов, получающих одновременно диуретики, однако врачу следует это учитывать.
Рифампицин.
Комбинация с рифампицином приводит к снижению AUC на 25 % и укорочению периода полувыведения флуконазола из плазмы на 20 %. Поэтому пациентам, получающим одновременно рифампицин, дозу флуконазола целесообразно увеличить.
Препараты, на которые влияет флуконазол:
Флуконазол является мощным ингибитором изофермента CYP2C9 и CYP2C19 цитохрома P450 и умеренным ингибитором изофермента CYP3A4. Кроме того, помимо перечисленных далее эффектов, существует риск повышения в плазме крови концентрации и других лекарственных средств, метаболизируемых изоферментами CYP2C9, CYP2C19 и CYP3A4 при одновременном приеме с флуконазолом. В связи с этим следует соблюдать осторожность при одновременном применении перечисленных препаратов, а при необходимости подобных комбинаций пациенты должны находиться под тщательным медицинским наблюдением. Следует учитывать, что ингибирующий эффект флуконазола сохраняется в течение 4-5 дней после отмены препарата в связи с длительным периодом полувыведения.
Азитромицин.
При одновременном применении внутрь флуконазола в однократной дозе 800 мг с азитромицином в однократной дозе 1200 мг выраженного фармакокинетического взаимодействия между обоими препаратами не установлено.
Алкалоиды барвинка.
Несмотря на отсутствие целенаправленных исследований, предполагается, что флуконазол может увеличивать концентрацию алкалоидов барвинка (например, винкристина и винбластина) в плазме крови и, таким образом, приводить к нейротоксичности, что, возможно, может быть связано с угнетением изофермента CYP3A4.
Алфентанил.
Отмечается уменьшение клиренса и объема распределения, увеличение периода полувыведения алфентанила. Возможно, это связано с ингибированием изофермента CYP3A4 флуконазолом. Может потребоваться коррекция дозы алфентанила.
Амитриптилин, нортриптилин.
Отмечается увеличение эффекта. Концентрацию 5-нортриптилина и/или S-амитриптилина можно измерить в начале комбинированной терапии с флуконазолом и через неделю после начала. При необходимости следует корректировать дозу амитриптилина/нортриптилина.
Амфотерицин
B. В исследованиях на мышах (в том числе с иммуносупрессией) были отмечены следующие результаты: небольшой аддитивный противогрибковый эффект при системной инфекции, вызванной
C. albicans,
отсутствие взаимодействия при внутричерепной инфекции, вызванной
Cryptococcus neoformans,
и антагонизм при системной инфекции, вызванной
A. fumigatus.
Клиническое значение данных результатов не ясно.
Бензодиазепины короткого действия (мидазолам, триазолам).
После приёма внутрь мидазолама флуконазол существенно увеличивает концентрацию мидазолама и психомоторные эффекты, причем это влияние более выражено после приема флуконазола внутрь, чем при его применении внутривенно. При необходимости сопутствующей терапии бензодиазепинами пациентов, принимающих флуконазол, следует наблюдать с целью оценки целесообразности соответствующего снижения дозы бензодиазепина.
При одновременном приёме однократной дозы триазолама флуконазол увеличивает AUC триазолама приблизительно на 50 %, Cmax — на 25-50 % и Т1/2 — на 25-50 %, благодаря угнетению метаболизма триазолама. Может понадобиться коррекция дозы триазолама.
Блокаторы «медленных» кальциевых каналов.
Некоторые антагонисты кальциевых каналов (нифедипин, исрадипин, амлодипин, верапамил и фелодипин) метаболизируются изоферментом CYP3A4. Флуконазол увеличивает системную экспозицию антагонистов кальциевых каналов. Рекомендован контроль развития побочных эффектов.
Варфарин.
При применении флуконазола с варфарином увеличивается протромбиновое время (в среднем на 12 %). В связи с этим в период терапии и в течение 8 дней после ее завершения рекомендуется тщательно следить за показателями протромбинового времени у пациентов, получающих препарат в сочетании с кумариновыми антикоагулянтами или производными индандиона. Также следует оценить целесообразность коррекции дозы антикоагулянта.
Витамин А.
Имеется сообщение об одном случае развития нежелательных реакций со стороны центральной нервной системы (ЦНС) в виде псевдоопухоли мозга при одновременном применении полностью трансретиноевой кислоты и флуконазола, которые исчезли после отмены флуконазола. Применение данной комбинации возможно, но следует помнить о возможности возникновения нежелательных реакций со стороны ЦНС.
Вориконазол (ингибитор изоферментов CYP2C9, CYP2C19 и CYP3A4).
Одновременное применение вориконазола (по 400 мг 2 раза в сутки в первый день, затем по 200 мг два раза в сутки в течение 2,5 дней) и флуконазола (400 мг в первый день, затем по 200 мг в сутки в течение 4 дней) приводит к увеличению концентрации и AUC вориконазола на 57 % и 79 %, соответственно. Было показано, что данный эффект сохраняется при уменьшении дозы и/или уменьшении кратности приема любого из препаратов.
Одновременное применение вориконазола и флуконазола не рекомендуется.
Галофантрин.
Флуконазол может увеличивать концентрацию галофантрина в плазме крови в связи с ингибированием изофермента CYP3A4. При одновременном применении с флуконазолом, как и с другими противогрибковыми препаратами азолового ряда, возможно развитие аритмии желудочковой тахисистолического типа «пируэт» (torsades de pointes), поэтому совместное применение галофантрина и флуконазола не рекомендуется.
Зидовудин.
У пациентов, получающих комбинацию флуконазола и зидовудина, наблюдается увеличение концентрации зидовудина, которое вызвано снижением превращения последнего в его главный метаболит, поэтому следует ожидать увеличения побочных эффектов зидовудина.
Ивакафтор.
При одновременном применении с ивакафтором, стимулятором муковисцидозного регулятора трансмембранной проводимости (CFTR), наблюдалось увеличение экспозиции ивакафтора в 3 раза и экспозиции гидроксиметил-ивакафтора (М1) в 1,9 раза. Пациентам, одновременно принимающим умеренные ингибиторы CYP3А, такие как флуконазол и эритромицин, рекомендуется снижение дозы ивакафтора до 150 мг один раз в сутки.
Ингибиторы ГМГ-КоА-редуктазы.
При одновременном применении флуконазола с ингибиторами ГМГ-КоА-редуктазы, метаболизируемыми изоферментом CYP3A4 (такими как аторвастатин и симвастатин) или изоферментом CYP2D6 (такими как флувастатин), риск развития миопатии и рабдомиолиза увеличивается. В случае необходимости одновременной терапии указанными препаратами следует наблюдать пациентов с целью выявления симптомов миопатии и рабдомиолиза. Необходимо контролировать концентрацию креатининкиназы. В случае значительного увеличения концентрации креатининкиназы или если диагностируется или имеется подозрение на развитие миопатии или рабдомиолиза, терапию ингибиторами ГМГ-КоА-редуктазы следует прекратить.
Карбамазепин.
Флуконазол угнетает метаболизм карбамазепина и повышает сывороточную концентрацию карбамазепина на 30 %. Необходимо учитывать риск развития токсичности карбамазепина. Следует оценить необходимость коррекции дозы карбамазепина в зависимости от концентрации/эффекта.
Лозартан.
Флуконазол угнетает метаболизм лозартана до его активного метаболита (Е-31 74), который отвечает за большую часть эффектов, связанных с антагонизмом ангиотензин-II рецепторов. Необходим регулярный контроль артериального давления.
Метадон.
Флуконазол может увеличивать плазменную концентрацию метадона. Может понадобиться коррекция дозы метадона.
Нестероидные противовоспалительные препараты (НПВП).
Cmax и AUC флурбипрофена увеличиваются на 23 % и 81 %, соответственно. Аналогично Cmax и AUC фармакологически активного изомера [S-(+)-ибупрофен] повышались на 15 % и 82 %, соответственно при одновременном применении флуконазола с рацемическим ибупрофеном (400 мг).
Несмотря на отсутствие целенаправленных исследований флуконазол может увеличивать системную экспозицию других НПВП, метаболизируемых изоферментом CYP2C9 (например, напроксен, лорноксикам, мелоксикам, диклофенак). Может понадобиться коррекция дозы НПВП.
При одновременном применении НПВП и флуконазола пациенты должны находиться под тщательным медицинским наблюдением с целью выявления и контроля нежелательных явлений и проявления токсичности, связанных с НПВП.
Пероральные гипогликемические средства — производные сульфонилмочевины (хлорпропамид, глибенкламид, глипизид, толбутамид).
Возможно увеличение периода полувыведения пероральных гипогликемических средств — производных сульфонилмочевины при одновременном приеме с флуконазолом.
Пероральные контрацептивы.
При одновременном применении комбинированного перорального контрацептива с флуконазолом в дозе 50 мг существенного влияния на уровень гормонов не установлено, тогда как при ежедневном приеме 200 мг флуконазола AUC этинилэстрадиола и левоноргестрела увеличиваются на 40 % и 24 % соответственно, а при приеме 300 мг флуконазола один раз в неделю AUC этинилэстрадиола и норэтиндрона возрастают на 24 % и 13 % соответственно. Таким образом, многократное применение флуконазола в указанных дозах вряд ли может оказать влияние на эффективность комбинированного перорального противозачаточного средства.
Преднизон.
Имеется сообщение о развитии острой недостаточности коры надпочечников у пациента после трансплантации печени на фоне отмены флуконазола после трехмесячного курса терапии. Предположительно, прекращение терапии флуконазолом вызвало повышение активности изофермента CYP3A4, что привело к увеличенному метаболизму преднизона. Пациенты, получающие комбинированную терапию преднизоном и флуконазолом, должны находиться под тщательным медицинским наблюдением при отмене приема флуконазола с целью оценки состояния коры надпочечников.
Рифабутин.
Имеются сообщения о взаимодействии флуконазола и рифабутина, сопровождавшегося повышением сывороточных концентраций последнего. При одновременном применении флуконазола и рифабутина описаны случаи увеита. Необходимо тщательно наблюдать пациентов, одновременно получающих рифабутин и флуконазол.
Саквинавир.
AUC повышается приблизительно на 50 %, Cmax — на 55 %, клиренс саквинавира уменьшается приблизительно на 50 % в связи с ингибированием печеночного метаболизма изофермента CYP3A4 и ингибированием P-гликопротеина. Может понадобиться коррекция дозы саквинавира.
Сиролимус.
Повышение концентрации сиролимуса в плазме крови, предположительно в связи с ингибированием метаболизма сиролимуса через угнетение изофермента CYP3A4 и P-гликопротеина. Данная комбинация может применяться с соответствующей коррекцией дозы сиролимуса в зависимости от эффекта/концентрации.
Такролимус.
Флуконазол повышает концентрацию такролимуса, в связи с чем возрастает риск нефротоксического действия. Пациентов, одновременно принимающих такролимус внутрь и флуконазол, следует тщательно наблюдать. Дозу такролимуса следует корректировать в зависимости от степени повышения его концентрации в крови.
Теофиллин.
В случае одновременного применения с теофиллином возможно снижение средней скорости клиренса теофиллина из плазмы. При назначении флуконазола пациентам, принимающим теофиллин в высоких дозах, или пациентам с повышенным риском развития токсического действия теофиллина, следует наблюдать за появлением симптомов передозировки теофиллина и, при необходимости, скорректировать терапию соответствующим образом.
Тофацитиниб.
Экспозиция тофацитиниба увеличивается при его совместном применении с препаратами, которые являются одновременно умеренными ингибиторами изофермента CYP3A4 и мощными ингибиторами изофермента CYP2С19 (например, флуконазол). Возможно, может понадобиться коррекция дозы тофацитиниба.
Фенитоин.
Одновременное применение флуконазола и фенитоина может привести к возрастанию концентрации фенитоина в плазме до клинически значимой степени. Поэтому при необходимости совместного применения этих препаратов нужно мониторировать концентрации фенитоина с коррекцией его дозы с целью поддержания концентрации препарата в пределах терапевтического интервала.
Фентанил.
Имеется сообщение об одном летальном исходе, возможно, связанном с одновременным приемом фентанила и флуконазола. Предполагается, что нарушения связаны с интоксикацией фентанилом. Было показано, что флуконазол значительно удлиняет время выведения фентанила. Следует учитывать, что повышение концентрации фентанила может привести к угнетению дыхательной функции.
Целекоксиб.
При одновременном применении флуконазола в дозе 200 мг/сут и целекоксиба в дозе 200 мг Cmax и AUC целекоксиба увеличиваются на 68 % и 134 % соответственно. В данной комбинации возможно снижение дозы целекоксиба вдвое.
Циклоспорин.
Возможно повышение концентрации циклоспорина при одновременном применении с флуконазолом в дозе 200 мг/сут.
Циклофосфамид.
При одновременном применении циклофосфамида и флуконазола отмечается увеличение сывороточных концентраций билирубина и креатинина. Данная комбинация допустима с учетом риска увеличения концентраций билирубина и креатинина.
Перечисленные взаимодействия установлены при многократном применении флуконазола; взаимодействия с лекарственными средствами в результате однократного приема флуконазола не известны. Врачам следует учитывать, что взаимодействие с другими лекарственными средствами специально не изучалось, но оно возможно. Исследования взаимодействия пероральных форм флуконазола при его одновременном приеме с пищей, циметидином, антацидами, а также после тотального облучения тела для подготовки к пересадке костного мозга показали, что эти факторы не оказывают клинически значимого влияния на всасывание флуконазола.
Показания к применению
Показаниями к применению капсул Флуконазол являются:
- Криптококковая инфекция, включая специфическое поражение оболочек головного мозга (криптококковый менингит) у пациентов на фоне иммунодефицита или с нормальным состоянием функциональной активности иммунитета.
- Тяжелая форма кандидоза с генерализацией инфекционного процесса и поражением значительного объема тканей (слизистые оболочки различных органов, кожа, брюшина, эндокард, глаза, дыхательные и мочевые пути). В большинстве случаев инфекция развивается на фоне выраженного снижения функциональной активности иммунной системы при злокачественных новообразованиях, лечении цитостатиками, иммуносупрессорами, а также у пациентов, находящихся длительное время в отделении интенсивной терапии.
- Локализованный кандидоз, развивающийся на слизистых оболочках полости рта и верхних отделов пищеварительного тракта, на структурах урогенитального тракта – препарат в лекарственной форме для системного применения используется в случае недостаточной эффективности мази или крема для местного применения.
- Дерматомикозы, которые локализуются на коже стоп, туловища, паховой области.
- Отрубевидный (разноцветный) лишай.
- Грибковое поражение ногтевых пластинок (онихомикоз).
- Глубокие эндемические микозы, которые могут включать паракокцидиомикоз, кокцидиомикоз, гистоплазмоз у пациентов с нормальной функциональной активностью иммунитета.
Препарат также применяется для профилактики развития грибковой инфекции у пациентов с нормальным или нарушенным иммунитетом.
Выбор антимикотических препаратов при комплексном лечении пациентов с кандидозом полости рта
М. О. Нагаева к. м. н., доцент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Минздрава РФ
М. Г. Чеснокова д. м. н., профессор, кафедра микробиологии, вирусологии и иммунологии ГОУ ВПО ОмГМА Минздрава РФ
И. В. Анисимова к. м. н., ассистент кафедры терапевтической стоматологии ГОУ ВПО ОмГМА Минздрава РФ
Истинная заболеваемость кандидозом полости рта в России неизвестна, поскольку он официально не регистрируется, поэтому публикации по этой проблеме в отечественной литературе немногочисленны [5]. Колонизация слизистых оболочек грибами Сandida у практически здоровых людей колеблется от 15 до 40 % и может возрасти до 80 % на фоне какой-либо патологии.
Актуальность исследования
Усиленный рост гриба, приводящий к развитию кандидоза, наблюдается при нарушении местного и системного иммунитета.
Возможно и экзогенное заражение. Поверхностный кандидоз слизистых возникает и у практически здоровых лиц. Глубокий кандидоз развивается при тяжелом иммунодефиците на фоне кандидозного стоматита, глоссита или фарингита. Через поврежденную слизистую грибы проникают в кровь, вызывая фунгемию и сепсис.
Лечение кандидоза должно быть индивидуальным для каждого больного с учетом локализации и остроты процесса и возможности наличия хронической стадии заболевания, с учетом иммунного статуса, наличия других заболеваний. Этиотропное лечение является наиболее важной составляющей комплексного лечения больных с кандидозом полости рта. Эрадикация возбудителя — первое мероприятие, после которого можно переходить к профилактике рецидивов и коррекции местных и общих предрасполагающих факторов. Этиотропная терапия может быть местной (в случае изолированного кандидозного поражения полости рта) и системной (при распространении инфекционного процесса на нижерасположенные отделы пищеварительного тракта, кожу, другие слизистые оболочки). Системная терапия кандидоза слизистой оболочки полости рта назначается, как правило, только при определенных показаниях: хронический гиперпластический кандидоз, эрозивно-язвенная форма кандидоза; кандидоз полости рта на фоне сахарного диабета, иммунодефицитного состояния; при неэффективной местной терапии.
Перечень антигрибковых препаратов огромен, и с каждым годом появляются новые препараты в виде ополаскивателей, растворов, таблетированных форм. Основную группу специфических препаратов составляют антимикотические средства, однако на сегодняшний день чувствительность к ним грибов Candida неодинаковая, а зачастую недостаточная. Тем не менее тесты на чувствительность не считаются рутинной процедурой, не всегда доступны и обычно не рассматриваются как стандартная методика в ведении больного. Тесты на чувствительность считаются полезными в тех случаях, когда мы имеем дело с глубокими инфекциями, обусловленными non-albicans видами Candida. В этих случаях, особенно если больного предварительно уже лечили антифунгальными азолами, должна быть рассмотрена возможность микробиологической резистентности.
Целью нашего исследования явилось определение чувствительности к антимикотикам штаммов грибов рода Сandida, выделенных у больных оральным кандидозом.
Материалы и методы
На базе кафедры терапевтической стоматологии ОмГМА и ГКСП № 1 г. Омска нами проведено клиническое обследование 48 пациентов с жалобами на боль и жжение в слизистой оболочке полости рта. Обследование проводилось согласно алгоритму, предложенному Недосеко В. Б., Анисимовой И. В. (2003) [3].
В комплексном обследовании пациентов проводилось микробиологическое исследование материала, полученного путем соскоба со слизистой оболочки спинки языка. Забор биоматериала осуществлялся до назначения лечебных мероприятий сухим стерильным тампоном без использования транспортной среды. Перед взятием микробиологического материала пациентам рекомендовали воздержаться от приема пищи и гигиенических процедур. Микробиологический материал помещался в стерильную транспортную пробирку и в течение двух часов доставлялся в баклабораторию. С целью выделения факультативно-анаэробных микроорганизмов, дрожжеподобных грибов рода Candida биоматериал засевали на питательные среды. Готовили серию последовательных двукратных разведений материала с 102 по 1012. Для выделения стафилококков осуществляли посев соответствующих разведений на желточно-солевой агар, для выявления стрептококков проводили посев на кровяной агар с азидом натрия. Для выделения бактерий рода Haemophilus и Neisseria материал засевали на шоколадный агар с линкомицином, энтеробактерий — на среду Эндо, для обнаружения энтерококков использовали энтерококковый агар.
Для выделения грибов рода Candida биоматериал засевали на среду Сабуро, Кандиселект.
Для идентификации грибов оценивали культуральные свойства на среде Кандисилект, биохимическую идентификацию проводили с помощью тест-системы «Ауксоколор».
Для определения чувствительности дрожжеподобных грибов рода Candida к антимикотическим препаратам (нистатин, амфотерицин В, клотримазол, флуконазол, итраконазол) использовали классический дискодиффузионный метод и Фунгитест.
Для постановки дискодиффузионного метода готовили взвесь культуры в изотоническом растворе хлорида натрия, 1 мл взвеси выливали на поверхность среды Мюллера — Хинтона. Учет результатов проводили путем измерения диаметра зоны подавления роста культуры к антимикотику.
Для проведения Фунгитеста готовили суспензию грибов из чистой культуры, выросшей на среде Сабуро, — первый калиброванный инокулят с мутностью, соответствующей стандарту 3 х 106 грибов/мл.
Разведение первичного раствора 1:20 добавляли в суспензионную среду для получения стандартного инокулята (103 КОЕ/мл). Стандартный инокулят вносили в лунки микропланшета. Инкубировали в течение 48 часов.
Результаты исследования и их обсуждение
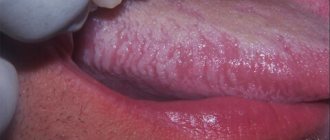
При обследовании 48 пациентов нами было выявлено 23 пациента с признаками орального кандидоза. Все пациенты предъявляли жалобы на боль, жжение, сухость во рту. У 60,8 % (14 пациентов) выявлялись клинические признаки хронического атрофического кандидоза (рис. 1), у 39,2 % (9 пациентов) был обнаружен хронический гиперпластический кандидоз (рис. 2).
Рис. 1. Пациентка К., 65 лет. Хронический атрофический кандидоз полости рта
Рис. 2. Пациентка И., 69 лет. Хронический гиперпластический кандидоз полости рта. Кандидозная заеда
В результате микробиологического исследования материала из полости рта 23 пациентов выделено и идентифицировано 75 штаммов условно патогенных микроорганизмов (48 штаммов Candida albicans, 27 штаммов условно патогенных бактерий). Большинство выделенных микроорганизмов высевалось в значимых концентрациях (104 КОЕ — 29,3 %, 106 КОЕ 40,0 %, 108 КОЕ — 22,7 %). При этом Candida albicans наиболее часто встречалась в ассоциации с S. epidermidis (104 КОЕ, 106 КОЕ), с E. faecalis (104 КОЕ, 106 КОЕ), S. salivarius (106 КОЕ). В ходе определения чувствительности грибов Candida аlbicans к антимикотическим препаратам выявлено 18 (37,5 %) штаммов с признаками резистентности. Наибольшая устойчивость выделенных штаммов грибов определялась к нистатину (33 % чувствительных штаммов) (рис. 3).
Рис. 3. Чувствительность к антимикотикам в дискодиффузионном методе
Чувствительность Candida аlbicans к итраконазолу, кетоконазолу, 5 флюороцитазину и миконазолу составила 100 % (рис. 3, 4).
Рис. 4. Чувствительность к антимикотикам в методе «Фунгитест»
При определении чувствительности к флуконазолу дискодиффузионным методом выявлено 94,4 % чувствительных к флуконазолу штаммов. При использовании метода «Фунгитест» чувствительность к флуконазолу в концентрации 8 составила 88,8 %, к флуконазолу в концентрации 64 — 100 %. К клотримазолу проявляли чувствительность 94,4 % штаммов C. аlbicans. Все выделенные штаммы были чувствительны к амфотерицину В(64), к амфотерицину В(8) — лишь 66,6 % штаммов. При определении чувствительности дискодиффузионным методом к амфотерицину В проявляли чувствительность 77,4 % исследуемых штаммов.
Заключение
При назначении этиотропного лечения пациентам с оральным кандидозом необходимо учитывать результаты микологического исследования с определением чувствительности к антимикотическим препаратам, так как у выделенных штаммов Candida аlbicans в 37 % случаев выявлена резистентность к антимикотикам. При выборе метода определения чувствительности к противогрибковым препаратам необходимо учитывать, что дискодиффузионный метод является ориентировочным, Фунгитест обладает выраженной специфичностью и высокой чувствительностью. Кроме того, методы отличаются спектром антимикотиков. Таким образом, для обеспечения оптимального выбора противогрибковых препаратов в практике можно рекомендовать использование двух методов — как дискодиффузионного, так и метода «Фунгитест».
- Анисимова И. В. Клиника, диагностика и лечение заболеваний слизистой оболочки полости рта / И. В. Анисимова, В. Б. Недосеко, Л. М. Ломиашвили. — М.: Медицинская книга, 2008. — 194 с.
- Боровский Е. В. Заболевания слизистой оболочки полости рта и губ / Е. В. Боровский, А. Л. Машкиллейсон. — М.: Медпресс, 2001. — 320 с.
- Недосеко В. Б. Алгоритм обследования больного с заболеваниями слизистой оболочки полости рта и губ /В. Б. Недосеко, И. В. Анисимова // Институт стоматологии. — 2003, № 2 (19). — С. 32—36.
Полный список литературы находится в редакции
Способ применения и дозировка
Капсулы Флуконазол предназначены для приема внутрь. Их не разжевывают и запивают достаточным количеством жидкости. Дозировка и режим применения препарата зависят от медицинских показаний:
- Криптококковый менингит у взрослых и детей старше 15-ти лет – в первый день препарат назначается в дозировке 400 мг в сутки, затем переходят на поддерживающую дозу 200 мг в день.
- Профилактика обострения криптококкового менингита у пациентов с выраженным иммунодефицитом, в частности на фоне СПИДа – после завершения курса первичной терапии, направленной на максимальное уничтожение возбудителя заболевания препарат назначается в суточной дозировке 200 мг.
- Генерализованный кандидоз – в первые дни назначается 400 мг в день, затем переходят на 200 мг в день. В случае отсутствия достаточного терапевтического эффекта снова переходят на дозу 400 мг.
- Кандидоз, локализующийся на слизистой оболочке полости рта, пищевода – 150 мг 1 раз в день от 14 до 28 дней (в зависимости от скорости достижения терапевтического результата).
- Вагинальный кандидоз у женщин (молочница) – 150 мг однократно, для профилактики обострения через 1 месяц прием препарата повторяется. Иногда при недостаточной эффективности и хроническом течения данной формы кандидоза врач устанавливает дозировку и режим применения, включая длительность курса терапии, индивидуально.
- Профилактика кандидоза различной локализации – дозировка устанавливается врачом индивидуально, она может варьировать от 50 до 400 мг в день.
- Отрубевидный лишай – 300 мг в день 1 раз в неделю в течение 3-х недель, данная схема при необходимости может корригироваться лечащим врачом.
- Дерматомикозы, включая поражение кожи стоп – 150 мг 1 раз в неделю 3-4 недели.
- Онихомикоз – 150 мг 1 раз в неделю, курс лечения продолжается до полного замещения ногтевой пластинки, при необходимости он может повторяться.
- Глубокие эндемические микозы – дозировка препарата варьирует от 200 до 400 мг в день, длительность курса терапии может достигать 24 месяцев.
Режим применения капсул Флуконазол у детей имеет определенные сходства со взрослыми. Важным условием является избегание превышения дозы 400 мг в сутки. В большинстве случаев режим применения, дозировка и длительность курса терапии устанавливаются врачом индивидуально.
Флуконазол в терапии кандидоза
В
последние годы существенно повысилась распространенность грибковых заболеваний, что связано с широким и не всегда рациональным применением антибиотиков, цитостатиков, кортикостероидных гормонов, повышением частоты внутрибольничных инфекций, развитием иммунодефицитных состояний.
Наиболее часто в клинической практике встречается кандидоз, вызываемый дрожжеподобным грибком Candida albicans
. Развитию кандидоза способствуют как местные, так и системные факторы. Например, при кандидозе кожи большое значение имеет наличие мацерации, опрелости, паронихий. Наиболее часто кандидоз встречается у больных сахарным диабетом, ВИЧ-инфекцией, гемобластозами, а также при длительном и неконтролируемом приеме антибиотиков и кортикостероидных гормонов.
Клинические проявления
кандидоза характеризуются поражением слизистых оболочек полости рта (стоматит), пищевода (эзофагит), урогенитального тракта, кожи и ногтей. К наиболее тяжелым проявлениям приводит гематогенная диссеминация (эндокардиты, менингиты, артриты, остеомиелиты, абсцесс головного мозга).
Кожные поражения при кандидозе характеризуются появлением пузырьков, пустул, которые быстро вскрываются и на их месте образуется эрозия. Очаги темно-красного цвета, блестящие, с влажной поверхностью, четкими границами и полоской отслаивающегося рогового слоя эпидермиса. У детей процесс может распространиться на кожу бедер, ягодиц, живота. Часто наблюдается появление межпальцевой кандидозной эрозии, чаще между III и IV IV и V пальцами кистей рук, реже стоп. Из субъективных ощущений отмечаются зуд, жжение, иногда болезненность в области поражения.
Кандидоз слизистой полости рта характеризуется поражением слизистой щек, языка, десен, углов рта. Процесс начинается с покраснения слизистой, затем появляются налеты белого цвета, сливающиеся с образованием крупных пленок. Вначале пленки легко отделяются, затем становятся плотными. В углах рта образуются трещины с выраженной мацерацией, отмечается жжение и болезненность при приеме пищи.
Кандидоз ногтевых валиков и ногтей начинается с покраснения и припухлости валика у основания ногтя, который набухает и при надавливании выделяется гной или сукровица. При внедрении грибковой инфекции в ногтевую пластинку она становится желтоватой, тусклой.
Урогенитальный кандидоз может протекать в острой или хронической форме. Острая форма характеризуется покраснением слизистой, наличием пузырьков, точечных эрозий и наличием творожистых или хлопьевидных, сливкообразных выделений. Пораженная слизистая имеет склонность к кровоточивости и появлению трещин в области преддверия влагалища и промежности. Зуд характерен для кандидоза вульвы, больших и малых половых губ, усиливается во время менструации, полового контакта и при длительной ходьбе. Для хронического урогенитального кандидоза характерны инфильтрация и трещины в области клитора, ануса, промежности и паховых складок. Кандидоз органов мочевыделения протекает в виде уретрита, цистита, пиелонефрита. Кандидозный цистит характеризуется частым мочеиспусканием, болями в надлобковой области. При уретрите появляются слизисто-гнойные выделения белого или желтого цвета, преимущественно в утреннее время. Зуд и жжение усиливаются при мочеиспускании.
Кандидозный баланопостит проявляется покраснением, отечностью головки полового члена, зудом и жжением при мочеиспускании. На соприкасающихся поверхностях головки и крайней плоти образуются пленки желтоватого цвета и рыхлая творожистая масса.
При кандидозе пищеварительного тракта развивается поражение пищевода, желудка, кишечника и желчного пузыря, что связано с распространением инфекции из полости рта и глотки. Больные жалуются на тошноту, отрыжку, рвоту, жидкий стул с примесью слизи, боли в животе. Слизистая оболочка гиперемирована, эрозирована, покрыта множественными налетами белого или желтого цвета.
Кандидозное поражение центральной нервной системы протекает по типу менингита, развивается в результате гематогенной диссеминации инфекции. Специфические клинические проявления отсутствуют, грибковая инфекция часто подтверждается только на аутопсии.
Гематогенная диссеминация грибковой инфекции C. albicans
сопровождается лихорадкой, токсическими и очаговыми проявлениями (абсцесс сетчатки, кандидоз эндокарда, артриты, менингит, пневмония).
Кандидозный сепсис развивается при поражении слизистой оболочки ротовой полости и пищевода у детей раннего возраста и у больных сахарным диабетом, ВИЧ-инфекцией. В клинической картине преобладают симптомы интоксикации, резкие подъемы и спады температуры, снижение артериального давления.
Диагностика кандидоза
основана на клинических проявлениях (зуд, жжение, налеты, отек слизистых, гиперемия и другие), микробиологических тестах (культивирование
in vitro
, гистология и выявление специфических антигенов в реакции иммунофлюоресценции с моноклональными антителами против
C. albicans
, выявление специфических антител методом иммуноферментного анализа).
Для лечения кандидоза
применяют антимикотические препараты системного действия (полиеновые антимикотики, триазольные производные, пиримидиновые производные и аллиламины). Среди триазольных производных ведущее место занимает
флуконазол (Микосист)
, являющийся селективным ингибитором синтеза стеролов в клетке грибка.
Флуконазол высокоактивен в отношении C. albicans
: лишь около 3-5% штаммов
C. albicans
резистентны к флуконазолу или имеют промежуточную чувствительность.
Candida krusei
и отдельные штаммы
Candida glabrata
резистентны к флуконазолу.
После перорального приема флуконазола более 90% препарата попадает в системный кровоток. Он отлично проникает в слюну, мокроту, мочу и другие тканевые жидкости. Выводится флуконазол преимущественно с мочой в неизмененном виде. Период полувыведения при нормальной функции почек – 27-34 ч. Микосист (флуконазол) выпускается в двух формах – для внутривенного и для перорального введения, пероральная форма обладает очень хорошей биодоступностью.
Флуконазол является препаратом выбора при кандидозной инфекции мочевыводящих путей, эзофагите, перитоните, раневой инфекции, используется в лечении фебрильных нейтропений. При урогенитальном кандидозе флуконазол назначают в дозе от 50 до 200 мг в сутки в течение 7-28 дней. При кандидозном эзофагите рекомендуется доза 400 мг с последующим снижением до 200 мг.
Флуконазол считается средством выбора в системной терапии кандидоза полости рта. При орофарингеальном кандидозе флуконазол взрослым назначают в дозе 100 мг один раз в сутки в течение 7-14 дней. При атрофическом кандидозе полости рта предпочтительно назначать флуконазол в дозе 50 мг в сутки в течение 14 дней. При развивающейся устойчивости C. albicans
дозу флуконазола повышают до 400–800 мг/сут. При частых рецидивах возможно назначение пульс–терапии флуконазолом (150 мг 1 раз в неделю). Интермиттирующие схемы позволяют предотвратить развитие устойчивости.
При кандидозе кожи эффективная доза флуконазола колеблется от 50 до 100 мг в сутки в течение 14-28 дней. При кандидозе кожи стоп мы рекомендуем дозу 150 мг в сутки в течение 14-28 дней.
Выбор лечения кандидной паронихии зависит от стадии процесса, выраженности воспаления, наличия кандидоза кожи или слизистых оболочек, онихомикоза. Флуконазол назначают при сопутствующем онихомикозе, сочетании паронихии с кандидозом кожи или слизистых оболочек. В этих случаях только местная терапия не гарантирует излечения и элиминации возбудителя. Флуконазол назначают по 150 мг 1 раз в неделю в течение 2–6 нед. Системную терапию можно сочетать с лечением местными антисептиками или противогрибковыми средствами.
Для профилактики кандидоза при проведении антибиотикотерапии доза флуконазола составляет от 50 до 300 мг в сутки однократно, в зависимости от риска развития грибковой инфекции.
У детей суточная доза составляет 3 мг/кг веса в сутки. В первый день целесообразно назначить ударную дозу 6 мг/кг в сутки. Длительность терапии у детей составляет от 1 до 14 дней, в зависимости от тяжести кандидозной инфекции.
Флуконазол хорошо переносится, побочные реакции встречаются в основном со стороны желудочно-кишечного тракта (боль в животе, тошнота, метеоризм), реже наблюдается головная боль, кожные высыпания.
Противопоказания к применению
Медицинскими противопоказаниями для приема капсул Флуконазол служат патологические и физиологические процессы в организме пациента, к которым относятся:
- Одновременный прием препарата терфинадина, астемизола, а также других лекарственных средств, которые приводят к удлинению интервала QT на электрокардиограмме (особенно в случае применения капсул Флуконазол в суточной дозировке, превышающей 400 мг).
- Детский возраст до 4-х лет.
- Индивидуальная непереносимость основного действующего компонента или дополнительных веществ данного медикаментозного средства.
С осторожностью лекарственное средство используется при сопутствующей печеночной или почечной недостаточности, появлении сыпи на коже у пациентов с генерализованными системными грибковыми инфекциями, одновременное применение препарата в суточной дозировке менее 400 мг с терфенадином, хроническом алкоголизме, в случае применения препаратов, которые обладают гепатотоксическим действием, а также у пациентов с высоким риском развития аритмии (нарушение ритма и частоты сокращений сердца) на фоне органической патологии сердца, нарушений электролитного баланса в организме. Также с осторожностью препарат используется у беременных женщин. Перед назначением капсул Флуконазол врач убеждается в отсутствии противопоказаний у пациента.
Побочные действия
Во время применения препарата Флуконазол возможны побочные действия
- Со стороны иммунной системы: гиперчувствительность (перекрестная со всеми азолами), другие анафилактические, анафилактоидные и аллергические реакции (в том числе синдром Стивенса-Джонсона, токсический эпидермальный некролиз, крапивница).
- Со стороны нервной системы: головная боль, головокружение, периферическая невропатия, парестезии, чрезмерная утомляемость, редко — судороги.
- Со стороны пищеварительной системы: снижение аппетита, сухость слизистой оболочки полости рта, изменения вкуса, боль в животе, рвота, тошнота, диарея, метеоризм, редко — нарушение функции печени (желтуха, гепатит, гепатонекроз, гипербилирубинемия, повышение активности аланинаминотрансферазы, аспартатаминотрансферазы, повышение активности щелочной фосфатазы, гепатоцеллюлярный некроз), в том числе тяжелое.
- Со стороны органов кроветворения: редко — лейкопения, тромбоцитопения (кровотечения, петехии), нейтропения, агранулоцитоз.
- Со стороны сердечно-сосудистой системы: увеличение продолжительности интервала QT, мерцание/трепетание желудочков, пируэтная тахикардия (torsade de pointes).
- Со стороны обмена веществ: гиперхолестеринемия, гипертриглицеридемия, гипокалиемия, гипергликемия.
- Со стороны опорно-двигательного аппарата: миалгия.
- Прочие: слабость, астения, периферические отеки, нейтропения, кожный зуд, отек легких, лихорадка, повышенная потливость, вертиго.
Применение в период беременности и лактации
Адекватных и контролируемых исследований применения флуконазола у беременных женщин не проводилось. Описано несколько случаев множественных врождённых пороков у новорождённых, матери которых на протяжении большей части или всего первого триместра получали терапию флуконазолом в высокой дозе (400-800 мг/сут). Были отмечены следующие нарушения развития: брахицефалия, нарушение развития лицевой части черепа, нарушение формирования свода черепа, волчья пасть, искривление бедренных костей, истончение и удлинение ребер, артрогрипоз и врождённые пороки сердца. В настоящее время нет доказательств связи перечисленных врождённых аномалий с применением низких доз флуконазола (150 мг однократно для лечения вульвовагинального кандидоза) в первом триместре беременности.
Во время беременности применения флуконазола следует избегать, за исключением случаев тяжелых и потенциально угрожающих жизни грибковых инфекций, когда ожидаемая польза лечения для матери превышает возможный риск для плода. Женщинам детородного возраста следует использовать средства контрацепции.
Поскольку концентрация флуконазола в грудном молоке и в плазме одинакова, применять препарат в период грудного вскармливания противопоказано.
Опыт применения микофлюкана (флуконазола) для лечения кандидозного вульвовагинита
Поражение человека дрожжеподобными грибами рода Candida впервые было описано в 1839 г. Б. Гантенбегом. Ему удалось обнаружить в буккальных язвах псевдомицелий грибка в виде белесовато-желтых пленок. Однако о существовании подобного заболевания еще в IV веке до н. э. упоминал Гиппократ. В 1849 г. идентичные грибы были обнаружены при влагалищных инфекциях. В 1880 г. Zops назвал микроорганизмы, вызывающие одновременные поражения слизистых ротовой полости и влагалища, Monilia albicans. Термин «Candida» был принят в 1939 г. III международным конгрессом микробиологов, в 1954 г. данный термин был подтвержден VIII Международным конгрессом ботаников.
Несмотря на более чем 150-летнюю историю изучения вегетирования в половом тракте женщин кандид, до настоящего времени в патогенезе и лечении данного заболевания остается ряд нерешенных вопросов.
Candida albicans — это диморфный комменсал, обитающий в половых путях и в желудочно-кишечном тракте, являющийся в 85–90% случаев этиологическим агентом кандидозного вульвовагинита. Кандидозные поражения могут быть обусловлены также Candida glabrata и Candida tropicalis, в более редких случаях — Candida guillermondii, Candida krusei, Saccharomyces cerevisiae.
Интерес акушеров-гинекологов к проблеме кандидоза обусловлен значительным удельным весом данной патологии в структуре гинекологических заболеваний.
Согласно многочисленным публикациям, у 75% женщин детородного возраста отмечаются эпизоды грибкового вульвовагинита, однако рецидивирующие формы заболевания возникают только в 5% случаев [1, 2].
Исследования последних лет свидетельствуют о том, что клетки влагалища обладают автономной иммунокомпетентностью и могут функционировать независимо от реакций системного иммунитета. Слизистая влагалища содержит большое количество эпителиальных клеток, дендритоподобных клеток Лангерганса, макрофагов и Т-лимфоцитов. Клеточный иммунитет обеспечивается мононуклеарными клетками и Т-лимфоцитами, которые осуществляют основную защитную функцию организма при системном кандидозе и кандидозе слизистых.
По мнению В. П. Прилепской [3], при вагинальном кандидозе патологический очаг чаще всего локализуется в поверхностных слоях эпителия влагалища. На этом уровне инфекция может персистировать длительное время ввиду того, что устанавливается динамическое равновесие между грибами, которые не могут проникнуть в более глубокие слои слизистой оболочки, и макроорганизмом, сдерживающим их проникновение, но не способным полностью элиминировать возбудитель. Нарушение этого равновесия приводит либо к обострению заболевания, либо к выздоровлению или ремиссии.
Как показало обследование пациенток с рецидивирующими формами кандидозного вульвовагинита, возникновению рецидивов могут способствовать особые штаммы Candida albicans, склонные к персистированию [4, 5]. Кроме того, частые рецидивы могут быть обусловлены нарушениями локального иммунитета слизистой оболочки влагалища [6].
К биологическим факторам, предрасполагающим к рецидивированию заболевания, следует также отнести уменьшение количества влагалищного экссудата, которое способствует дрожжевой колонизации [7].
Различают 3 клинические формы генитального кандидоза:
- бессимптомную колонизацию;
- острый урогенитальный кандидоз;
- хронический (рецидивирующий) урогенитальный кандидоз.
Бессимптомная колонизация влагалища Candida albicans встречается у 15—20% молодых небеременных женщин и женщин в пременопаузе. Дрожжеподобные грибы присутствуют во влагалище в небольшом количестве (<103 МОЕ/мл) и представлены псевдомицелиями. Для колонизации влагалища достаточно введения в него всего лишь 102 МОЕ/мл клеток Candida albicans. При кандидоносительстве жалобы и выраженная клиническая картина отсутствуют. В посевах обнаруживаются почкующиеся формы дрожжевых грибов в малых количествах при отсутствии псевдомицелия.
Острая форма заболевания характеризуется типичной клинической симптоматикой, ее продолжительность не превышает 1-2 месяцев.
Рецидивирующую форму заболевания диагностируют при наличии у больной 4 и более клинически выраженных эпизодов кандидозной инфекции в год. Ранее ведущее место в ее генезе отводили инфицированию полового тракта кандидами видов не-albicans [1]. Однако, по мнению В. Е. Маликова и соавт. (2002), такое объяснение хронизации процесса недостаточно обоснованно. В большей степени оно обусловлено неправильной тактикой лечения больных, осуществляющегося без учета чувствительности к антимикотикам, и назначением антимикотиков по общепринятой схеме [8].
Использование иммунологических методов позволило выделить 3 категории женщин с рецидивирующим кандидозом. Установлено, что клеточно-опосредованные иммунные ответы типов Тh1 и Th2 коррелируют с устойчивостью и восприимчивостью к развитию кандидоза слизистых.
I тип иммунного ответа — тип Тh1, сопровождающийся продукцией интерлейкинов-2, γ-интерферона, интерлейкина-12 (стимулирующего макрофаги и полиморфно-ядерные клетки), а также IgА-антител, является доминирующей реакцией влагалища, обеспечивающей поддержание бессимптомной колонизации кандид. II тип иммунного ответа — типа Th2 с продукцией интерлейкина-4, интерлейкина-5, интерлейкина-10, IgE-антител, гистамина и простагландина Е2 — становится доминирующим в тех случаях, когда под действием эндогенных или экзогенных факторов количество Candida albicans возрастает. При III типе иммунного ответа тип Th2 выключает ответ типа Тh1 и стимулирует развитие реакции гиперчувствительности замедленного типа.
Несмотря на создание и внедрение в клиническую практику большого числа местных и ряда системных противогрибковых препаратов, лечение кандидозного вульвовагинита представляет собой достаточно сложную задачу. При этом наиболее трудно решаемой проблемой является подбор терапии для больных с формировавшейся резистентностью грибов к различным антимикотическим средствам. В значительной мере это обусловлено естественной устойчивостью определенных видов Candida к используемым в клинической практике противогрибковым препаратам.
Большинство препаратов местного действия обладает в основном фунгистатическим действием, что во многом и способствует формированию устойчивости к антимикотикам. Современные системные пероральные антимикотики, относящиеся к классу азолов, являются селективными ингибиторами синтеза эргостерола — основного компонента клеточной мембраны грибов, т. е. обладают фунгицидным действием. Для того чтобы ингибиторы эргостеролового синтеза начали действовать, необходимо их проникновение внутрь грибковой клетки, накопление в достаточной концентрации, перемещение к микросомам, на которых расположен фермент-мишень и связь с этим ферментом [8].
Преимущество использования относящегося к классу бис-триазолов препарата микофлюкан (флуконазол) производства (Индия) определяется, прежде всего, тем, что в отличие от кетоконазола, который помимо антимикотических свойств обладает умеренным антиандрогенным эффектом и влияет на ряд других обменных процессов, микофлюкан не воздействует на метаболический профиль.
Целью настоящей работы явилась оценка эффективности однократного приема микофлюкана 150 мг перорально для лечения кандидозного вульвовагинита.
Проведено открытое исследование, в котором микофлюкан в капсулах по 150 мг был назначен 31 женщине в возрасте от 20 до 55 лет (средний возраст 31,8±0,4 года, средняя масса тела 63±0,6 кг). В исследование были включены пациентки, у которых диагноз кандидозного вульвовагинита подтверждался микроскопически (микоскопия мазков, окрашенных по Граму). В случаях неэффективности терапии назначали вторую дозу микофлюкана с последующим микроскопическим контролем вагинальных мазков через 10 дней.
Все пациентки предъявляли жалобы на чувство дискомфорта, зуд наружных гениталий, умеренные или обильные творожистые выделения из влагалища. Диагноз вагинального кандидоза 20 женщинам был поставлен впервые, 11 пациенток в анамнезе имели несколько эпизодов молочницы, по поводу чего ранее получали курсы пероральной терапии низоралом или местное лечение клотримазолом, клионом, пимафуцином, гино-травогеном. Длительность заболевания составляла от 1 до 6 лет. 20 женщин длительное время страдали воспалительными процессами половых органов, по поводу чего им проводились многократные курсы антибиотикотерапии. У 10 пациенток отмечены явления цервицита и/или эктопии шейки матки, у 1 — кандиломы вульвы, 2 пациентки страдали сахарным диабетом.
Излечение констатировали при исчезновении клинических симптомов заболевания, улучшение — при значительном ослаблении субъективных и объективных признаков заболевания и отсутствие эффекта — при сохранении или усилении симптомов заболевания.
Контрольное клиническое и микроскопическое обследования проводили через 10 дней после приема препарата. По результатам контрольного лабораторного исследования влагалищных мазков лечение оценивалось как эффективное при отсутствии спор и мицелия грибов и как неэффективное — при выявлении последних при микроскопии мазков, окрашенных по Граму.
Результаты проведенного исследования показали, что после однократного приема 150 мг микофлюкана у большинства пациенток (61,3%) на вторые-третьи сутки терапии было отмечено улучшение клинических симптомов заболевания. Через 10 дней симптомы заболевания (зуд, обильные бели, гиперемия и отек слизистой оболочки влагалища) исчезли у 29 (93,5%) из 31 женщин. У 2 женщин, одна из которых страдала сахарным диабетом, а другая — ВПЧ-инфекцией (вирус папилломы человека), сохранялись клинические проявления вагинита. При контрольной микроскопии мазков у обеих пациенток повторно обнаружили грибы, в связи с чем им был назначен второй курс лечения микофлюканом. После повторного приема препарата удалось достичь лечебного эффекта.
Таким образом, по данным микроскопии мазков, выполненной через 10 дней после приема препарата, микологическая эффективность лечения микофлюканом составила 93,5%. После повторного приема микофлюкана микологическая эффективность была достигнута в 100% случаев. Толерантность к препарату равнялась 100%. Побочных реакций отмечено не было.
Проведенное исследование позволило выявить высокую эффективность однократного перорального применения 150 мг микофлюкана при лечении эпизодов кандидозного вульвовагинита и клинически подтвердить уникальные фармакологические свойства препарата.
Полученные данные согласуются с результатами других авторов, отметивших клиническое излечение и микологическую элиминацию возбудителя у 90,5—92,1% пациенток [9, 10]. Проведенное исследование позволило установить отчетливую связь эффективности лечения с наличием в анамнезе у больных предрасполагающих к кандидозу факторов, среди которых, с нашей точки зрения, особое значение следует придавать формированию относительного иммунодефицитного состояния. Чаще подобные ситуации возникают при одновременной контаминации возбудителей инфекции, передающихся половым путем. В нашем случае мы не получили эффекта у пациентки, инфицированной вирусом папилломы человека 16 и 18 типов, которой ранее многократно проводилось различное антимикотическое лечение. По мнению С. И. Роговской [10], клиническая манифестация папилломовирусной инфекции сопровождается изменениями системного и локального иммунитета, что проявляется в увеличении выработки фактора некроза опухолей и снижении интерлейкина-10 клетками эпителия, в снижении индукции γ-интерферона и повышении содержания интерферона в периферической крови, а также в изменениях клеточного иммунитета, что и способствовало персистенции вагинального кандидоза. Отсутствие эффекта от однократной дозы микофлюкана у больной 55 лет с тяжелым сахарным диабетом, которой не проводилось адекватное лечение, направленное на поддержание состояния эугликемии, можно трактовать двояко. Повышенное содержание глюкозы в моче и клетках влагалищного эпителия при тяжелом течении диабета, а также дистрофия последнего могут служить предрасполагающими факторами для внедрения и размножения грибов [1]. Согласно данным Sobel и соавт. [11], диабет и климактерический период являются предрасполагающими факторами вегетирования в половом тракте этих женщин грибов вида C. glabrata, которые исходно устойчивы к флуконазолу. По мнению В. Е. Маликова и соавт. [8], существуют 2 типа клинического течения хронического кандидозного вульвовагинита. Один из типов предполагает истинную (не микробиологическую) резистентность. Под этим подразумевается хронический рецидивирующий кандидоз как синдром, развивающийся на фоне дефектов иммунной системы и профиля сенсибилизации к антигенам грибов. Единственным возбудителем указанного синдрома является Candida albicans.
Второй тип условно можно охарактеризовать ложной резистентностью. Он обусловлен инфицированием грибом, отличным от Candida albiсans, но пролеченным по стандартной традиционной схеме, без учета этиологической принадлежности инфекции. По данным Czaika и соавт. (2000), терапия флуконазолом в дозах менее 800 мг/сут не превышает барьеры адаптации для C. glabrata [12].
Следует отметить отсутствие побочных реакций на фоне приема микофлюкана и его высокую комплаентность, что в значительной степени повышает приверженность к лечению. Отсутствие эффекта в 6,5% от однократного приема 150 мг микофлюкана, по-видимому, диктует необходимость индивидуального подбора антимикотиков с учетом видовой селекции штаммов Candida и предрасполагающих факторов развития кандидоза. Таким образом, 150 мг микофлюкана в виде 1 табл. для приема внутрь можно считать эффективным средством для лечения эпизодов кандидозного вульвовагинита.
Литература
- Прилепская В. Н., Байрамова Г. Р. Вагинальный кандидоз: этиопатогенез, клиника, диагностика, принципы терапии // Контрацепция и здоровье женщины. — 2002. — №1. — С. 3—8.
- Geiner AM. Foxman В. Risk factors in vulvo-vaginal candidiasis: a case kontrol study among college students// Epidemiology -1996;7:182-7.
- Прилепская В. П. Вульвовагинальный кандидоз: современные методы лечения // Практическая гинекология. — М., 2001. — С. 177—189.
- Vazquez J. A., Sobel JD, Demitriou R, Vaishampayan J, Lynch M, Zervos M. J. Karyotyping of Candida Albicans isolates obtained longitudinally in women with recurrent vulvovaginal candidiasis. J Infect Dis 1994;170:1566-9.
- Spinillo A, Carratta L, Pizzolli G, et all Recurrent vaginal candidiasis: result of a cochort study of sexual transmission and intestinal reservoir// J Reprod Med 1992;37:343-7.
- Fidel P. J. Jr, Sobel J. D. Immunopathogenesis of recurrent vulvovaginal candidiasis. Clin Microbiol Rev 1996;9;335-48.
- Hilton E., Ch and rase karan V., Rindos P., Iscnberg H. D. Association of recurrent Candidas vaginitis with inheritance of Lewis blood group antigens. J. Infect Dis 1995; 172:1616-9.
- Маликов В. Е., Жарикова Н. Е., Романовская Т. А., Рассказов Д. Н. Этиология вагинального кандидоза и проблема устойчивости к антимикотикам// Контрацепция и здоровье женщины. — 2002. — №1. — С. 9—16.
- Анкирская А. С., Муравьева В. В., Демидова Е. М., Карпова О. Ю., Зайдиева Я. З., Фурсова С. А. Дифлюкан 150: опыт лечения и профилактики вагинального кандидоза // Вестник дерматологии и венерологии. — 1998. — №3. — С. — 65–67.
- Роговская С. Н., Прилепская В. Н., Байрамова Г. Р. Опыт применения дифлюкана при лечении генитального кандидоза //Вестник дерматологии и венерологии. — 1997. — №1. — С. 100-101.
- Sobel J., Faro S., Forse R. et al. Vulvovaginal candidiasis: Epidemiologic, diagnostic, and therapeutic considerations // Am.J.Obstet.Gynecol.- 1998.-Vol. 178.-P. 203—211
- Роговская С. И. Папилломовирусная инфекция нижних отделов гениталий: клиника, диагностика, лечение // Диссертация… док. мед. наук. — 2003.
- Czaika Vertal antifungal susceptibility testing in chronically recurrent vaginal candidosis as basis for effection therapy// Mycoses 2002-Vol. 43/Suppl 2- p 45-50.
В. П. Сметник, доктор медицинских наук, профессор Л. А. Марченко, доктор медицинских наук Г. Е. Чернуха, доктор медицинских наук Научный центр акушерства, гинекологии и перинатологии РАМН, Москва
Особые указания
Лечение флуконазолом можно начинать до получения результатов посева и других лабораторных анализов, но после получения результатов этих исследований терапию необходимо изменить соответствующим образом.
В ходе лечения необходимо контролировать показатели крови, функцию почек и печени. При возникновении нарушений функций почек и печени следует прекратить прием препарата.
Лечение необходимо продолжать до появления клинической и гематологической ремиссии (исключением является острый влагалищный кандидоз). Преждевременное прекращение лечения приводит к рецидивам.
Больные СПИДом более склонны к развитию тяжелых кожных реакций при применении многих препаратов. В тех случаях, когда у больных с поверхностной грибковой инфекцией развивается сыпь и она расценивается как определенно связанная с флуконазолом, препарат следует отменить. При появлении сыпи у больных с инвазивными / системными грибковыми инфекциями, их следует тщательно наблюдать и отменить флуконазол при появлении буллезных изменений или многоформной эритемы.
В редких случаях применение флуконазола сопровождалось токсическими изменениями печени, в том числе с летальным исходом, главным образом у больных с серьезными сопутствующими заболеваниями. В случае гепатотоксических эффектов, связанных с флуконазолом, не отмечено явной зависимости их от общей суточной дозы, длительности терапии, пола и возраста больного. Гепатотоксическое действие флуконазола обычно было обратимым; признаки его исчезали после прекращения терапии. При появлении клинических признаков поражения печени, которые могут быть связаны с флуконазолом, препарат следует отменить.