Получение в промышленности
Фторид натрия — довольно полезное соединение, поэтому синтезируется он в промышленных масштабах. Мировое производство составляет более 10000 тонн в год. В большинстве случаев сырьем являются гексафторсиликаты, которые также получают искусственно. На производстве их подвергают щелочному гидролизу, в результате которого в реакционной смеси выделяется фторид натрия. Но его еще необходимо отделить от примесей оксида кремния и силиката натрия. Делают это зачастую обыкновенной фильтрацией.
Но гексафторсиликаты даже при термическом разложении или при взаимодействии с карбонатом натрия могут давать фторид натрия. Это также может быть использовано при промышленном синтезе.
Также в промышленности существует способ получения фторида натрия из кальцинированной соды (карбоната натрия) и плавиковой кислоты. В результате их взаимодействия с помощью фильтрации удается получать технически чистый продукт:
Na2CO3 + HF → 2NaF + CO2 + H2O
Получение в лаборатории
В лаборатории возможны и другие способы получения этого соединения. Самый простой — это реакция нейтрализации гидроксида натрия плавиковой кислотой. Другой вариант: взаимодействие гидроксида натрия с фторидом аммония. Гидроксид натрия может давать фторид и при взаимодействии с простым фтором.
В теории фторид натрия можно получать и из простых веществ: натрия и фтора. Эта реакция протекает очень бурно, хотя на практике ее проводят очень редко.
F2 + 2Na → 2NaF
Еще один способ получения — это термическое разложение дифторгидрата и некоторых комплексных солей. В этом случае получается продукт очень высокой чистоты.
Na(HF2) → NaF + HF
При окислении простого фтора броматом натрия или другими окислителями, содержащими натрий, в качестве продукта может получаться фторид натрия.
F2 + NaBrO3+ 2NaOH → NaBrO4 + 2NaF + H2O
Взаимодействием трифторида бора с гидридом натрия, также можно получить эту соль.
BF3 + NaOH → Na3BO3 + NaF + H2O
Класс опасности
Фтористый натрий является токсичным и ядовитым веществом. Присвоен фториду натрия класс опасности 2. Особенно токсичен при попадании в дыхательные пути и в органы пищеварения. Отравление веществом приводит к нарушениям работы сердечно-сосудистой системы, скачкам артериального давления, раздражению желудочного тракта, включая появление язв.
При отравлении фтористым натрием проявляются такие симптомы:
- тошнота, диарея и рвота;
- слюно- и слезотечение;
- падение уровня артериального давления;
- повышение температуры тела;
- нарушения зрения.
Вред фтористый натрий приносит и при попадании на кожу, что способствует появлению сильных химических ожогов.
Химические свойства
В водных растворах фторид натрия диссоциирует и образует комплексное соединение.
NaF + 4H2O → [Na(H2O)4]+ + F-
При взаимодействии с плавиковой кислотой образуется дифторгидрат. Но при избытке фтороводорода могут образовываться иные комплесксные соединения, которые называются гидрофториды натрия. Их состав может быть разным в зависимости от соотношения реагентов.
Как видно из химической формулы, фторид натрия — это типичная соль, поэтому он вступает в реакции обмена с другими солями, если в результате реакции образуется осадок или газ. При взаимодействии с кислотами выделяется газообразный фтороводород. А с гидроксидом лития образуется осадок фторида лития.
Фторид натрия может образовывать и другие комплексные соли, в зависимости от реагентов и условий реакции.
Применение
Фторид натрия обладает хорошими антисептическими свойствами, поэтому его иногда добавляют в моющие средства. По той же причине он используется для обработки древесины. Раствор этой соли помогает бороться с плесенью, грибком и насекомыми. Чаще всего используют трехпроцентный раствор. Он хорошо проникает в древесину и защищает ее от гниения. Но у этого средства есть недостаток, из-за которого фторид натрия редко используют, — он легко вымывается из древесины во время дождей, так как эта соль хорошо растворима в воде.
Он также используется при синтезе некоторых химических соединений, в частности фреонов и инсектицидов. Ионы фтора останавливают гликолиз (окисление глюкозы), поэтому фторид натрия применяют для биохимических исследований.
Часто его используют и в металлургической промышленности для очистки поверхностей металлов, а также при их плавке и пайке. Вещество иногда добавляют и в цемент, делая бетон стойким к воздействию кислот, и в смазки для повышения термостойких качеств.
Самое спорное его применение — это добавление в зубные пасты. Для зубов фторид натрия — это источник фтора, который необходим для придания костям и зубам прочности, также служит для профилактики кариеса. Но при высоком потреблении этого элемента могут возникать негативные последствия. Поэтому до сих пор ведутся споры о применении фторидов в качестве добавок для зубной пасты.
Что представляет собой фторид и как он работает
Фторид является формой элементарного фтора, который в обычном состоянии представляет собой токсичный газ. Химические реакции фтора с другими соединениями, такими как олово, придают ему уникальные свойства, которые увеличивают эффективность элемента в плане обработке полости рта.
Попадая в рот, фторид разбавляется слюной, осаждаясь в виде бактериальной бляшки на поверхности зубов. В таком состоянии он напрямую ингибирует рост бактерий, поэтому во рту образуется меньше кислоты. Затем фторид, хранящийся в бляшке, высвобождается, когда бактерии продуцируют достаточное количество кислоты для снижения кислотно-щелочного баланса во рту. Когда это происходит, фторид диффундирует в зуб через крошечные поры в эмали. Ионы фтора заменяют гидроксильные ионы кристаллов гидроксиапатита, которые составляют зубную эмаль, и образуют новое соединение, называемое фторапатитом. Это соединение почти не растворяется в кислотах, производимых бактериями в полости рта, поэтому помогает защитить зубы от разрушения.
Позитивное влияние фтора на организм
Фтор является довольно важным микроэлементом в организме человека, без которого невозможна нормальная его жизнедеятельность. В сутки необходимо потреблять 0,03 мг фтора на килограмм массы тела для взрослого человека. Ребенку же необходимо в 5 раз больше.
Функции фтора в организме очень разнообразны. Он способствует правильному росту и формированию костей, волос и ногтей, так как стабилизирует кальций в процессе минерализации. Особенно это важно во время роста и развития детей, а также при переломах. Этот элемент необходим для поддержания иммунитета. Железо лучше усваивается организмом, если в этом процессе участвует фтор.
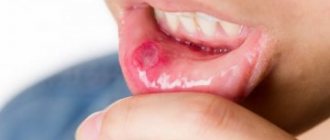
При недостатке этого элемента ослабляется зубная эмаль, возрастает риск кариеса. У детей в этом случае могут появляться дефекты при развитии скелета. У взрослых появляется риск развития остеопороза. Это заболевание характеризуется пониженной плотностью костей, из-за чего возрастает их хрупоксть.
Проблемы при избытке фтора в организме
При повышенном содержании фтора в организме может возникнуть флюороз. Это заболевание характеризуется рядом необратимых последствий. В начальных периодах развития болезни страдает зубная эмаль. На ней появляются пятна разной формы и цвета. Пятна легко диагностируются стоматологом, и при своевременном лечении от них можно без труда избавится. Для отбеливания часто используют растворы неорганических кислот, раствор перекиси водорода или растворы других перекисей. После отбеливания эмали проводят реминерализацию раствором глюконата кальция. При лечении более тяжелых форм флюороза рекомендуется приминать глюконат кальция внутрь до окончания терапии. Если при флюорозе возникла эрозия зубной эмали, то применяют композитные материалы и восстанавливают форму зуба, примерно так же, как при пломбировании.
В качестве профилактики данного заболевания можно снизить поступление фтора в организм, если его концентрация в питьевой воде велика. Для этого обычно заменяют источник воды либо же просто проводят фильтрацию. Также можно убрать из рациона продукты, в которых содержится много фтора: морскую рыбу, животное масло, шпинат. Может помочь введение в пищу витаминов С и D, а также глюконата кальция.
Если избыток фтора наблюдается на протяжении длительного периода (10-20 лет), начинают страдать кости. Возникает остеосклероз, при котором, в отличие от остеопороза, плотность костей становится выше нормы, что приводит к снижению их упругости. Это также может стать причиной частых переломов. Но переживать не стоит. Настолько сильный переизбыток фтора в организме может возникнуть только у людей, работающих на производстве фторидов без соблюдения техники безопасности.
Ссылки [ править ]
- Wells, John C. (2008), Словарь произношения Longman
(3-е изд.), Longman, стр. 313 и 755, ISBN 9781405881180 . Согласно этому источнику, альтернативное произношение второго слова / е л ɔːr aɪ д / и, в Великобритании, а также / е л ¯u ə г aɪ д / . - Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике
(92-е изд.). CRC Press . п. 5.194. ISBN 978-1439855119 . - Льюис, Опасные свойства RJ Sax промышленных материалов. 10-е изд. Тома 1–3 Нью-Йорк, Нью-Йорк: John Wiley & Sons Inc., 1999., стр. 3248
- ^ ab
Sigma-Aldrich Co. , Фторид натрия . Проверено 17 марта 2015. - ^ abc
Карманный справочник NIOSH по химической опасности. «# 0563» . Национальный институт охраны труда и здоровья (NIOSH). - Мартель, B .; Кэссиди, К. (2004), Анализ химического риска: Практическое руководство
, Баттерворт-Хайнеманн, стр. 363, ISBN 978-1-903996-65-2 - «Топ 300 2020» . ClinCalc
. Проверено 11 апреля 2021 . - «Фторид натрия — Статистика употребления наркотиков» . ClinCalc
. Проверено 11 апреля 2021 . - Bourne, редактор тома, Джеффри Х. (1986). Диетические исследования и рекомендации по здоровью и болезням
. Базель: Каргер. п. 153. ISBN. 978-3-8055-4341-5 . - Jr, Корнелис Кляйн, Корнелиус С. Херлбут (1999). Руководство по минералогии: (по Джеймсу Д. Дане)
(21-е изд., Ред. Ред.). Нью-Йорк: Дж. Вили. ISBN 978-0-471-31266-6 . - Селвиц, Роберт H; Исмаил, посреди меня; Питтс, Найджел Б. (январь 2007 г.). «Кариес». Ланцет
.
369
(9555): 51–59. DOI : 10.1016 / S0140-6736 (07) 60031-2 . PMID 17208642 . S2CID 204616785 . - Отдел гигиены полости рта, Национальный центр по профилактике услуг, CDC (1993), Фторирование Перепись 1992
(PDF) , извлекаются 2008-12-29 . CS1 maint: несколько имен: список авторов ( ссылка ) - Haguenauer, D; Велч, В; Ши, B; Tugwell, P; Уэллс, Г. (2000). «Фторид для лечения постменопаузального остеопороза». Кокрановская база данных систематических обзоров
(4): CD002825. DOI : 10.1002 / 14651858.CD002825 . PMID 11034769 . - Вестергаард, P; Jorgensen, NR; Schwarz, P; Mosekilde, L (март 2008 г.). «Влияние лечения фтором на минеральную плотность кости и риск переломов — метаанализ». Osteoporosis International
.
19
(3): 257–68. DOI : 10.1007 / s00198-007-0437-6 . PMID 17701094 . S2CID 25890845 . - Блау, Монте; Ганатра, Раманик; Бендер, Меррилл А. (январь 1972 г.). «18F-фторид для визуализации костей». Семинары по ядерной медицине
.
2
(1): 31–37. DOI : 10.1016 / S0001-2998 (72) 80005-9 . PMID 5059349 . - Ордонез, AA; Демарко, вице-президент; Klunk, MH; Поккали, С .; Джайн, СК (октябрь 2015 г.). «Визуализация хронических туберкулезных поражений с использованием натриевой [18F] фторид-позитронно-эмиссионной томографии у мышей» . Молекулярная визуализация и биология
.
17
(5): 609–614. DOI : 10.1007 / s11307-015-0836-6 . PMC 4561601 . PMID 25750032 . - Грант, ФО; Fahey, FH; Packard, AB; Дэвис, RT; Алави, А .; Treves, ST (12 декабря 2007 г.). «Скелетный ПЭТ с 18F-фторидом: применение новой технологии к старому индикатору» . Журнал ядерной медицины
.
49
(1): 68–78. DOI : 10,2967 / jnumed.106.037200 . PMID 18077529 . - Хальперн, DF (2001), «фторид натрия», Энциклопедия Реагенты для органического синтеза
, John Wiley & Sons , DOI : 10.1002 / 047084289X.rs071 , ISBN 978-0471936237 - ^ abc
Aigueperse, Жан; Моллард, Поль; Девилье, Дидье; Chemla, Marius; Фарон, Роберт; Романо, Рене; Куэр, Жан-Пьер (2000). «Соединения фтора неорганические».
Энциклопедия промышленной химии Ульмана
. Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a11_307 . - Хаус, Джеймс Э .; Хаус, Кэтлин А. (10.09.2015). Описательная неорганическая химия
. Академическая пресса. п. 397. ISBN. 978-0-12-802979-4 . - Меткалф, Роберт Л. (2007), «Контроль над насекомыми», Энциклопедия промышленной химии Ульмана
(7-е изд.), Wiley, стр. 9 - ^ ab
Капп, Роберт (2005), «Фтор»,
Энциклопедия токсикологии
,
2
(2-е изд.), Elsevier, стр. 343–346. - Грин Шеперд (2005), «Фтор», Энциклопедия токсикологии
,
2
(2-е изд.), Elsevier, стр. 342–343 - Паспорт безопасности данных NaF . hazar.com
- CDC — Карманный справочник NIOSH по химической опасности
- Мюррей TM, Ste-Marie LG. Профилактика и лечение остеопороза: консенсусные заявления Научного консультативного совета Канадского общества остеопороза. 7. Фторидная терапия остеопороза . CMAJ
. 1996. 155 (7): 949–54. PMID 8837545 . - Национальный совет здравоохранения и медицинских исследований (Австралия). Систематический обзор эффективности и безопасности фторирования
[PDF]. 2007. ISBN 1-86496-415-4 . Резюме: Yeung CA. Систематический обзор эффективности и безопасности фторирования.
Доказанная вмятина
. 2008. 9 (2): 39–43. DOI : 10.1038 / sj.ebd.6400578 . PMID 18584000 . - Уэллс, AF (1984), Структурная неорганическая химия
, Оксфорд: Clarendon Press , ISBN 978-0-19-855370-0 - «Химическая и физическая информация», Токсикологический профиль фторидов, фтористого водорода и фтора
(PDF) , Агентство по регистрации токсичных веществ и заболеваний (ATDSR), сентябрь 2003 г., стр. 187 , дата обращения 01.11.2008 - Справочник по минералам
(PDF) , публикация минеральных данных, 2005.
Фторирование воды
Как уже было сказано выше, фтор может использоваться для профилактики кариеса. По этой причине в середине прошлого века в некоторых странах начали применять фторирование водопроводной воды. Его суть напоминает хлорирование. В воду добавляют небольшое количество фторида натрия или иного компонента, содержащего фтор, для придания ей определенных свойств. Сегодня в США фторируется 2/3 всей воды.
Чтобы человек получал необходимое количество фтора, по данным Всемирной организации здравоохранения, питьевая вода должна содержать 0,5-1,0 мг фтора в литре. Но обыкновенная вода не всегда содержит такое количество, поэтому приходится увеличивать его искусственно.
Фторирование воды никак не влияет на ее вкус или запах. Благодаря этому процессу очень сильно снижается риск заболевания кариесом, особенно среди детей. Это происходит из-за того, что фтор уничтожает бактерии, которые могут растворять эмаль зубов и вызывать кариес.
Конечно, повышенное содержание фтора может привести к флюорозу, но, согласно авторитетным исследованиям, фторирование воды не может являться причиной развития данной патологии. Других побочных действий у такой воды также не наблюдается. Хотя в последнее время стали появляться некоторые низкокачественные исследования, говорящие об обратном. Набирал популярность и миф, что фторирование воды служит способом для утилизации фторидов, которые являются отходом алюминиевых предприятий. Но эта версия не нашла подтверждения.
Употребление фторированной воды не рекомендуется лишь при некоторых заболеваниях: диабете, гормональных нарушениях, артрите, болезнях щитовидной железы, почек и сердца.
В любом случае воду несложно избавить от присутствия фтора. Фильтры, работающие по принципу обратного осмоса, удаляют почти весь фтор, а дистилляция очищает воду от него полностью. Бытовые фильтры также могут частично или полностью задерживать фтор в себе. Пропуская воду через глинозем, костную муку или костный уголь можно также убрать фтор из воды. Некоторые фториды (например, фторид кальция) нерастворимы в воде, поэтому можно использовать метод осаждения, чтобы перевести весь фтор в осадок. Для этого зачастую используют известь.
Применение в фармакологии
Фторид натрия является действующим веществом некоторых лекарственных препаратов. Как правило, прием таких таблеток осуществляется по назначению врача, иногда терапия требует специального наблюдения и сопровождается регулярными исследованиями динамики протекания. Торговые названия препаратов фтора: «Натрия фторид», «Натриум флуоратум» и «Оссин». Их прописывают при недостатке фтора в организме, в частности при остеопорозе.
Препарат в виде драже и таблеток принимают внутрь. Почти весь фтор усваивается организмом, вне зависимости от приема пищи. Обычно такую терапию сочетают с приемом кальция и магния по 1-1,5 г в сутки. Это помогает костям более стабильно минерализоваться.
Но препарат опасно принимать свыше нормы. В таком случае может возникнуть избыток фтора, приводящий к флюорозу. При приеме лекарственных средств, содержащих фторид натрия, необходимо наблюдаться у стоматолога, чтобы предупредить развитие флюороза.
Взаимодействие
Инструкция указывает, что соли кальция связывают фторсодержащие соединения в желудочно-кишечном тракте. Кроме этого, препараты, в основе которых лежат алюминий или магний, имеют аналогичный эффект. Лекарства, которые обладают обволакивающими свойствами, также препятствуют усвоению фтора, поэтому их надо принимать отдельно. Усиливать действие натрия фторида могут витамины А и D.
Лечение натрия фторидом эффективно при борьбе с кариесом и остеопорозом, однако всегда необходимо соблюдать рекомендации врача и периодически сдавать анализ крови для предупреждения возможных побочных действий.