| Фтор | |
| Атомный номер | 9 |
| Внешний вид простого вещества | Фтор в сосуде Бледно-жёлтый газ, чрезвычайно химически активен. Очень ядовит. |
| Свойства атома | |
| Атомная масса (молярная масса) | 18,998403 а. е. м. (/моль) |
| Радиус атома | 71 пм |
| Энергия ионизации (первый электрон) | 1680,0 (17,41) кДж/моль () |
| Электронная конфигурация | [He] 2s2 2p5 |
| Химические свойства | |
| Ковалентный радиус | 72 пм |
| Радиус иона | (-1e)133 пм |
| Электроотрицательность (по Полингу) | 3,98 |
| Электродный потенциал | 0 |
| Степени окисления | −1 |
| Термодинамические свойства простого вещества | |
| Плотность | (при −189 °C)1,108 /³ |
| Молярная теплоёмкость | 31,34 /(·моль) |
| Теплопроводность | 0,028 /(·) |
| Температура плавления | 53,53 |
| Теплота плавления | (F-F) 0,51 кДж/моль |
| Температура кипения | 85,01 |
| Теплота испарения | 6,54 (F-F) кДж/моль |
| Молярный объём | 17,1 ³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | моноклинная |
| Параметры решётки | 5,50 b=3,28 c=7,28 β=90.0 |
| Отношение c/a | — |
| Температура Дебая | n/a |
| F | 9 |
| 18,9984 | |
| [He]2s22p5 | |
| Фтор | |
Фтор
— элемент главной подгруппы седьмой группы, второго периода периодической системы химических элементов Менделеева, с атомным номером
9
. Обозначается символом
F
Fluorum. Фтор — чрезвычайно химически активный неметалл и самый сильный окислитель, является самым лёгким элементом из группы галогенов. Простое вещество
фтор
(CAS-номер: 7782-41-4) при нормальных условиях — двухатомный газ бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор (формула F2). Очень ядовит.
История
Схема атома фтора
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту.
Как один из атомов плавиковой кислоты, элемент фтор был предсказан в 1810 году, а выделен в свободном виде лишь семьдесят шест лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия
Название «фтор» (φθόρος — разрушение), предложенное Андре Ампером в 1810 году, употребляется в русском и некоторых других языках; во многих странах приняты названия, производные от латинского «Fluorum» (которое происходит, в свою очередь, от fluere
— «течь», по свойству соединения фтора, флюорита (CaF2), понижать температуру плавления руды и увеличивать текучесть расплава).
Как выражается дефицит фтора в организме?
Причинами дефицита фтора в организме могут быть нарушения метаболизма, не позволяющие усваиваться ему в нужных количествах, и недостаточное поступление его извне. Во втором случае, как правило, речь идёт о бедной фтором питьевой воде (менее 0,7 мг/л).
Характерные симптомы нехватки фтора – это поражение зубов кариесом, их хрупкость, а также развитие остеопороза. Ногти и волосы также становятся ломкими, плохо растут. Вследствие уменьшения содержания в организме железа, которое плохо усваивается без фтора, может возникнуть анемия.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание |
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека | 0,01 |
В природе значимые скопления фтора содержатся разве что только в минерале флюорите.
В некоторой степени относительно богаты фтором растения чечевица и лук
Содержанием в почве фтор обязан вулканическим газам, за счет того, что в их состав обычно входит большое количество фтороводорода.
Распространенность Фтора
По распространенности во Вселенной фтор занимает 24 место. Его присутствие в космосе оценивается как низкое. Для сравнения остальные элементы группы могут встречаться до 20 раз больше. Если взять соотношение, то количество фтора в районе 400 частей на миллиард. Такая низкая концентрация связана с тем, что процессы звездного нуклеосинтеза протекают без присутствия фтора. Любые образованные атомы фтора имеют высокое ядерное сечение, что в дальнейшем позволяет слиться с водородом или гелием для концентрации кислорода или неона.
Что же касается Земли, то фтор является тринадцатым по распространенности в земной коре. По массе соотношение частей варьируется около цифры 400 частей на миллион. Фтор, как чистое вещество, в природе не встречается. Вместо этого он встречается в виде фторсодержащих минералов. Самым распространенным из них является флюорит (CaF2). На нашей планете более 9 тысяч месторождений этого минерала. Крупнейшими поставщиками флюорита являются Китай и Мексика. Еще двумя фторсодержащими минералами являются фторопатит, топаз и криолит.
Читайте: Углерод как химический элемент таблицы Менделеева
Изотопный состав
Фтор является моноизотопным элементом, так как в природе существует только один стабильный изотоп фтора 19F. Известны еще 17 радиоактивных изотопов фтора с массовым числом от 14 до 31, и один ядерный изомер — 18Fm. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4.722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2.629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2.094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Электронное строение
Применение метода МО для молекулы F2
Электронная конфигурация атома фтора следующая: 1s22s22p5. Атомы фтора в соединениях могут проявлять степень окисления равную −1. Положительные степени окисления в соединениях не реализуются, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — ²P3/2
Строение молекулы
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбители и 3 разрыхляющих. Очевидно, что порядок связи в молекуле равен 1.
Почему фтор нужен для организма человека?
А теперь ответим на центральный вопрос статьи: почему, для чего фтор нужен для организма человека? Больше всего этого микроэлемента содержится в наших зубах (0,02 %), костях (0,2–1,2 %), щитовидной железе и коже. В меньшей мере обнаруживается он практически во всех биологических субстанциях. В среднем – около 2,6 грамма во всём теле.
Пожалуй, все наслышаны о пользе фторсодержащих зубных паст. Оспаривать данный факт не приходится, ведь фтор (в малых количествах, конечно) необходим для формирования и поддержания, укрепления покрывающей зубную ткань эмали и самого дентина. Он, вступая в соединение с кальцием и фосфором,предотвращает развитие кариеса, появление микротрещин. Однако в местностях, где питьевая вода в должной мере обогащена данным микроэлементом, не стоит постоянно пользоваться фторированными пастами, так как это может вызвать флюороз – перенасыщенность тканей фтором, что выражается обычно в пятнистости, потемнении эмали, а что ещё хуже – в нарушениях структуры и деформациях костей.Присутствие фторида в пище будущей мамы способствует рождению ребёнка, менее подверженного кариесу.
Кости также будут более прочными при достатке этого минерала. Фтор нужен для нормального роста скелета, он ускоряет восстановление в случае переломов. Для пожилых людей фтор ценен как средство предупреждения остеопороза.
Воздействие фтора на щитовидную железу заключается в угнетении её активности, что давно взято на вооружение врачами при лечении ряда эндокринных отклонений, таких как гипертиреоз (базедова болезнь).
Отмечено положительное влияние оптимального содержания фтора в организме на иммунную систему и функции кроветворения, на регенерацию при ранах и ожогах, а также на усвоение железа.
Выявлено радиопротекторное (защищающее от радиации) действие фтора: он препятствует отложению радионуклида стронция в костных тканях и защищает от облучения стронцием, способствует выведению солей тяжёлых металлов.
Как видим, участвуя в минеральном обмене, фтор оказывает разностороннее действие на организм человека.
Получение
Лабораторный метод получения фтора
Источником для производства фтора служит фтористый водород HF, получающийся в основном либо при действии серной кислоты H2SO4 на флюорит CaF2, либо при переработке апатитов и фосфоритов.
Лабораторный метод
Лабораторные условия — фтор можно получать с помощью химических установок. В медный сосуд 1, заполненный расплавом KF·3HF помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца (II) и глицерина.
В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C:
K2MnF6 + 2SbF5 → 2KSbF6 + MnF3 + ½F2 2K2MnF6 + 4SbF5 → 4KSbF6 + 2MnF3 + F2 Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен.
Промышленный метод
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·3HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Чем опасен переизбыток фтора в организме? Отравление фтором
Переизбыток фтора в организме может оказаться для человеческого организма гораздо большим злом, нежели его недостаток. Только 20 мг этого минерала вызывают серьёзное отравление фтором, а 2 грамма смертельны.
Острое отравление газообразным фтором вызывает поражение глаз (ожоги, конъюнктивиты, экземы век) и органов дыхания (изъязвление слизистых оболочек, потерю голоса, кровотечения из носа, бронхит, пневмонию), а также резкое нарушение кровообращения. Могут пострадать печень, сердечная мышца, вероятно развитие лейкопении, различных отклонений в работе сердечно-сосудистой и нервной систем, метаболических нарушений. При отравлении через желудочно-кишечный тракт (например ядом для мышей) начинаются судороги, резкое понижение давления, тошнота, кровавые рвота и понос, велика вероятность впадения в кому.
Хроническое отравление фтором (фторизм) также несёт серьёзную угрозу для здоровья, тем более что его диагностика затруднена. Причиной может быть чрезмерно фторированная вода (больше 4 мг/л), не утилизованные по правилам промышленные отходы, отравляющие внешнюю среду, несоблюдение техники безопасности на производстве суперфосфатов, отравление почв и растений агрохимикатами и др. Сначала зубы и дёсны становятся крайне чувствительными, затем наблюдается стирание зубов, поражение их кариесом, пародонтозы, кровотечения из носа. Поражаются бронхи, лёгкие, сердце, ЖКТ, печень, система кровообращения и сосуды… В общем, патологические изменения нарастают, как снежный ком, и затрагивают весь организм, что может при продолжении интоксикации и отсутствии лечения привести к инвалидности и преждевременной смерти.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (редкие исключения — фторопласты), и с большинством из них — с горением и взрывом. Контакт фтора с водородом приводит к воспламенению и взрыву даже при очень низких температурах (до −252°C). В атмосфере фтора горят даже вода и платина:
2F2 + 2H2O → 4HF + O2
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
XeF8 → XeF6 + F2 MnF4 → MnF3 + 1/2 F2
Фтор также способен окислять кислород, образуя фторид кислорода OF2.
Фторирование зубов в стоматологических
В проводится глубокое фторирование по современной A.P.F. системе.
Фторирование зубов — процедура для профилактики и укрепления поверхностных и глубоких слоев тканей зуба. Для зубов необходимы два вещества – кальций и фтор, но они все время вытесняют друг друга с поверхности эмали. Поэтому появился новый препарат A.P.F. гель, на основе нанотехнологий, который способен насытить глубокие слои эмали кальцием, а верхние – фтором. В процедура фторирования зубов по A.P.F. системе занимает 10-20 минут. Для закрепления эффекта от процедуры на дом выдается средство для дальнейшего домашнего ухода. Данная процедура позволяет не только защитить зубы от кариеса, но и восстановить эмаль с уже имеющимся на поверхности кариесом.
Применение в химической деятельности (химической промышленноси)
Газообразный фтор используется для получения:
гексафторида урана UF6 из UF4, применяемого для разделения изотопов урана для ядерной промышленности. трёхфтористого хлора ClF3 — фторирующий агент и мощный окислитель ракетного топлива шестифтористой серы SF6 — газообразный изолятор в электротехнической промышленности фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами фреонов — хороших хладагентов тефлонов — химически инертных полимеров гексафтороалюмината натрия — для последующего получения алюминия электролизом различных соединений фтора
Ракетная техника
Соединения фтора широко применяются в ракетной технике как окислитель ракетного топлива.
Применение в медицине
Соединения фтора широко применяются в медицине как кровезаменители.
Применение
Значит. часть cвободного Ф. идёт на получение разнообразных фторсодержащих материалов (электролитов, растворителей, лаков, ПАВ, смазочных жидкостей, инсектицидов, пестицидов, заменителей крови, фармацевтич. препаратов и др.). Ф. используют в произ-ве гексафторида урана UF6, трифторида бора BF3, фторидов графита CFn и др. элементов (WF6, NF3, SF6, CF4, SbF5, XeF6 и др.). Применяют в эксимерных лазерах на ArF* или KrF*.
Ф. высокотоксичен. Раздражает кожу, слизистые оболочки носа и глаз; вызывает дерматиты, ожоги кожи, конъюнктивиты, отёк лёгких.
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариеса и флюорозу (крапчатости эмали) и остеосаркомы, соответственно.
Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фтора или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50 %.
Предельно допустимая концентрация связанного фторав воздухе промышленных помещениях равен 0,0005 мг/литр.
Физиологическое действие
В организме взрослого человека содержится около 2,6 г F. Практически весь он включен в состав костей и зубов. В этом и заключается главная ценность данного микроэлемента – он укрепляет наши кости и зубы. Но как же кальций?
Ведь общеизвестно, что именно кальций – вот тот строительный цемент, что придает прочность костной ткани. Да, это так. Но тогда причем здесь фтор?
А фтор как раз и облегчает отложение кальция в костной ткани. Вместе с кальцием откладывается еще один важный для костей и зубов элемент, фосфор. Эти два макроэлемента, кальций и фосфор, находятся в костях и в зубах в виде фосфата кальция, точнее, его разновидности, апатита.
Структурная основа молекул апатитов имеет вид Са10(РО4)6. К ней могут присоединяться ионы хлора, фтора, и гидроксид-ионы (ОН).
В этой связи различают фторапатиты, хлорапатиты, и гидроксиапатиты. Самый прочный из них – фторапатит. Фтор делает кристаллическую структуру апатитов более упорядоченной, и препятствует их разрушению под действием кислой среды. Он может изначально присоединяться к молекуле апатита, или как наиболее активный химический элемент вытеснять из нее гидроксид-ионы.
В итоге фторапатиты усиливают минерализацию костей и зубов, и тем самым придают им прочность. F предупреждает деминерализацию костей, связанную с изменениями рН (кислотности), инфекцией, обменными нарушениями, и другими повреждающими факторами. Тем самым он предотвращает развитие таких часто встречающихся негативных явлений, как кариес зубов и остеопороз костей.
Зубной кариес – сложный патологический процесс. Немаловажную роль в его развитии играет кислотообразующая микрофлора полости рта. Под ее действием глюкоза расщепляется до органических кислот.
В итоге величина РН в полости рта снижается, а кислотность, соответственно, повышается. При этом на зубной эмали образуются пятна, а непосредственно под пятнами формируются очаги разрушения.
Он стимулирует процессы реминерализации, восстановления в поврежденной эмали и в глубжележащих тканях зуба, дентине, и тем самым устраняет имеющиеся дефекты.
В костной ткани он контролирует правильное отложение фосфата кальция. Благодаря ему снижается риск переломов, а полученные переломы быстрее срастаются.
В детском и юношеском возрасте при участии фтора правильно формируется костный скелет.
Следует заметить, что кости и зубная эмаль не являются лидерами по содержанию фтора. Больше его в зубном цементе. Затем идет костная ткань, зубной дентин, и уж потом – зубная эмаль. Помимо костей и зубов F позитивно влияет на состояние ногтей и волос, стимулирует их рост, повышает прочность.
Кроме того, он входит в состав некоторых тканевых ферментов. С этими ферментами он способствует синтезу лейкоцитов, и повышает иммунитет. Установлено, что микроэлемент угнетает рост кислотообразующей бактериальной микрофлоры полости рта. Благодаря этому он оказывает дополнительное действие при зубном кариесе.
Не только образование лейкоцитов, но и эритроцитов, гемоглобина, стимулирует фтор. Это связано с тем, что он участвует в обмене железа. Благодаря этому он позитивно влияет на состояние кроветворения, сердечно-сосудистой системы. При его участии происходит связывание и выведение солей тяжелых металлов, радионуклидов, и других токсических соединений.
Суточная потребность
Потребность в F зависит от возраста и от некоторых других факторов.
| Категория | Суточная норма, мг |
| Дети до 2 лет | 0,5-0,7 |
| Дети 3-5 лет | 0,9 |
| Дети 6-8 лет | 1,1 |
| Дети 9-13 лет | 1,3 |
| Подростки, юноши и девушки | 1,5 |
| Взрослые, мужчины и женщины | 1,7-4 |
| Беременные и кормящие | 4 |
Во время заболеваний, интенсивных физических нагрузок, суточная потребность в F может возрастать до 5 мг.
Причины и признаки дефицита
Основная причина дефицита фтора связана с низким содержанием этого элемента в питьевой воде в некоторых регионах. Из-за этого недополучают его растения и животные, которые служат источниками пищи для людей, проживающих в этих регионах.
Показатели содержания фтора в воде:
| Содержание в питьевой воде, мг/л | Значение |
| До 0,3 | Очень низкое |
| 0,3-0,7 | Низкое |
| 07-1,2 | Оптимальное, нормальное |
| 1,2-1,5 | Допустимое, но повышенное |
| 1,5-2 | Выше допустимого |
| 2-6 | Высокое |
| 6-15 | Очень высокое |
В некоторых источниках показатели содержания фтора вводе отображаются в ммоль/л. При этом распределение его на территории РФ выглядит следующим образом.
Иногда человек сам искусственно снижает его количество в питьевой воде. Используемые для очистки фильтры удаляют из воды не только токсичные примеси, но и фтор. Наряду с низким содержанием в воде и в почвах дефицит F может быть обусловлен несбалансированным питанием, низким потреблением рыбы, морепродуктов, и другой пищи, богатой им.
Еще одна причина – систематическое употребление некоторых лекарств. Дело в том, что алюминий и магний ухудшают его усваивание. То же самое касается лекарственных средств, содержащих эти элементы. Это Панангин, Аспаркам, Кардиомагнил, используемые в кардиологической практике, и не только.
Антациды, средства для снижения кислотности желудочного сока (Алмагель, Маалокс), содержат в виде гидроксидов и алюминий, и магний. При хронических заболеваниях ЖКТ (желудочно-кишечного тракта) ухудшается усваивание многих нутриентов, в т.ч. и фтора.
Дефицит его проявляется зубным кариесом и патологической ломкостью костей на фоне остеопороза. При выраженном дефиците выпадают зубы. Особенно подвержены остеопорозу пожилые и старики. Его дефицит в преклонные годы увеличивает риск перелома шейки бедра и других костных переломов.
В детском и юношеском возрасте недостаток фтора – одна из причин искривлений позвоночника: сколиоза, усиленного кифоза. Кроме того, пациенты с его недостатком часто страдают анемиями. У них снижен иммунитет, и из-за этого повышается восприимчивость к инфекциям. Ухудшается внешний вид. Волосы становятся ломкими, и выпадают. Ногтевые пластинки расслаиваются.
Источники поступления
С водой мы получаем 2/3 необходимого нам фтора, а остальное 1/3 – с пищей. Лидер по содержанию F – зеленый чай. Много его в рыбе, в морепродуктах, в мясе и в орехах.
Содержание F в 100 г продуктов:
| Продукт | Содержание, мг/100 г |
| Чай зеленый | 10 |
| Тунец | 1,5 |
| Скумбрия | 2 |
| Треска | 0,7 |
| Лосось | 0,5 |
| Камбала | 0,43 |
| Устрицы | 0,4 |
| Грецкие орехи | 0,65 |
| Баранина | 0,2 |
| Курятина | 0,15 |
| Молоко | 0,1 |
| Редис | 0,85 |
| Гречка | 0,1 |
| Картофель | 0,1 |
Следует заметить, что при варке продуктов определенное количество F переходит в воду. Чтобы уменьшить потери микроэлемента, пищу следует варить в небольшом объеме воды, и желательно не превышать необходимое время.
При этом крайне нежелательно пользоваться алюминиевой посудой. Рыбу лучше не варить, а запекать. Рыба с костями предпочтительнее в плане содержания фтора, чем рыбное филе. Рыбные консервы тоже богаты им.
Синтетические аналоги
Фторсодержащие соединения входят в состав зубных паст. Эти пасты укрепляют зубы и предотвращают кариес. F в составе зубных паст представлен следующими соединениями:
| Соединение | Характеристики |
| Фторид олова | Оказывает выраженное реминерализирующее действие на зубную эмаль. Способствует отбеливанию эмали зубов. Однако под его действием отбеленная эмаль через какое-то время темнеет. Негативно влияет на состояние десен. Из-за отрицательных качеств в настоящее время не используется. |
| Монофосфат натрия | Фтор из этого соединения высвобождается медленно. Поэтому оно малоэффективно. |
| Аминофторид | Реминерализация максимальна. На поверхности зубной эмали соединение образует пленку. Из этой пленки фтор проникает в эмаль и в глубжележащие ткани зуба. |
| Фторид натрия | Быстро распадается с образованием ионов F, и потому действует точно так же быстро. |
| Никометанола фторгидрат (Фторинол) | По способности фиксироваться и проникать в зубную эмаль и дентин в 12 раз превосходит неорганические соединения фтора. |
Таким образом, фторид натрия (другое название – натрия флюорат) является одним из наиболее популярных средств.
Его используют не только в виде зубных паст, но и в виде растворов для полоскания рта, таблеток и растворов для приема внутрь (Витафтор, Кореберон, Оссин), лаков для нанесения на эмаль зубов (Профлюорид Варниш, Бифлюорид 12, Фторлак).
Гель для зубов Сенсигель и зубная паста Эльгифлуор в качестве активного вещества содержат Фторинол.
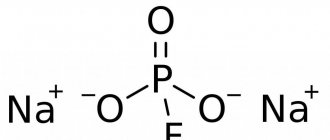
Помимо этих средств он входит в состав ряда биодобавок и комплексных витаминно-минеральных препаратов. Фторид натрия, фторсалицилат натрия, и фторкремниевую кислоту используют для фторирования воды. Данные соединения обладают рядом преимуществ:
- дешево стоят
- хорошо растворяются в воде
- безопасны для здоровья
- не изменяют свойств воды: сохраняют ее прозрачность, не придают ей вкус и запах.
Доказано, что периодическое фторирование водопроводной воды в регионах с низким содержанием F укрепляет зубы и снижает частоту кариеса.
Метаболизм
Фтор с водой и пищей поступает в виде неорганических соединений. Некоторое количество микроэлемента может поступать через дыхательные пути, всасываться через кожу. Поступивший в ЖКТ фтор путем простой или облегченной диффузии всасывается в желудке и в начальных отделах тонкого кишечника.
Усваиваемость фтора максимальная, приближается к 100%. Всосавшийся он разносится кровью по органам и тканям. До 99% F сосредоточено в костях и зубах, а остальных тканях – всего 1%. Практически весь F выводится из организма с мочой. Лишь незначительное количество может покидать организм с потом и калом.
Взаимодействие с другими веществами
Обмен фтора тесно связано с обменом кальция и фосфора – благодаря ему эти макроэлементы откладываются в костях и в зубах. Однако в больших дозах он негативно влияет на обмен кальция. Вит. А и Е улучшают его усваивание.
Алюминий и магний наоборот, ухудшают этот процесс. То же самое касается препаратов, содержащих соединения алюминия и магния. Фтор улучшает усваивание железа. Усваивание других галогенов, брома, иода, хлора, он ухудшает.
Дополнительная информация
Фториды Соединения фтора в ракетной технике Соединения фтора в медицине Категория:Соединения фтора
Фтор, Fluorum, F(9)
Фтор (Fluorine, франц. и нем. Fluor) получен в свободном состоянии в 1886 г., но его соединения известны давно и широко применялись в металлургии и производстве стекла. Первые упоминания о флюорите (СаР,) под названием плавиковый шпат (Fliisspat) относятся к XVI в. В одном из сочинений, приписываемых легендарному Василию Валентину, упоминаются окрашенные в различные цвета камни — флюссе (Fliisse от лат. fluere — течь, литься), которые применялись в качестве плавней при выплавке металлов. Об этом же пишут Агрикола и Либавиус. Последний вводит особые названия для этого плавня — плавиковый шпат (Flusspat) и минеральный плавик. Многие авторы химико-технических сочинений XVII и XVIII вв. описывают разные виды плавикого шпата. В России эти камни именовались плавик, спалт, спат; Ломоносов относил эти камни к разряду селенитов и называл шпатом или флусом (флус хрустальный). Русские мастера, а также собиратели коллекций минералов (например, в XVIII в. князь П. Ф. Голицын) знали, что некоторые виды шпатов при нагревании (например, в горячей воде) светятся в темноте. Впрочем, еще Лейбниц в своей истории фосфора (1710) упоминает в связи с этим о термофосфоре (Thermophosphorus).
По-видимому, химики и химики-ремесленники познакомились с плавиковой кислотой не позднее XVII в. В 1670 г. нюрнбергский ремесленник Шванхард использовал плавиковый шпат в смеси с серной кислотой для вытравливания узоров на стеклянных бокалах. Однако в то время природа плавикового шпата и плавиковой кислоты была совершенно неизвестна. Полагали, например, что протравливающее действие в процессе Шванхарда оказывает кремневая кислота. Это ошибочное мнение устранил Шееле, доказав, что при взаимодействии плавикового шпата с серной кислотой кремневая кислота получается в результате разъедания стеклянной реторты образующейся плавиковой кислотой. Кроме того, Шееле установил (1771), что плавиковый шпат представляет собой соединение известковой земли с особой кислотой, которая получила название «Шведская кислота».
Лавуазье признал радикал плавиковой кислоты (radical fluorique) простым телом и включил его в свою таблицу простых тел. В более или менее чистом виде плавиковая кислота была получена в 1809 r. Гей-Люссаком и Тенаром путем перегонки плавикового шпата с серной кислотой в свинцовой или серебряной реторте. При этой операции оба исследователя получили отравление. Истинную природу плавиковой кислоты установил в 1810 г. Ампер. Он отверг мнение Лавуазье о том, что в плавиковой кислоте должен содержаться кислород, и доказал аналогию этой кислоты с хлористоводородной кислотой. О своих выводах Ампер сообщил Дэви, который незадолго до этого установил элементарную природу хлора. Дэви полностью согласился с доводами Ампера и затратил немало усилий на получение свободного фтора электролизом плавиковой кислоты и другими путями. Принимая во внимание сильное разъедающее действие плавиковой кислоты на стекло, а также на растительные и животные ткани, Ампер предложил назвать элемент, содержащийся в ней, фтором (греч.- разрушение, гибель, мор, чума и т. д.). Однако Дэви не принял этого названия и предложил другое — флюорин (Fluorine) по аналогии с тогдашним названием хлора — хлорин (Chlorine), оба названия до сих пор употребляются в английском языке. В русском языке сохранилось название, данное Ампером.
Многочисленные попытки выделить свободный фтор в XIX в. не привели к успешным результатам. Лишь в 1886 г. Муассану удалось сделать это и получить свободный фтор в виде газа желто-зеленого цвета. Так как фтор является необычайно агрессивным газом, Муассану пришлось преодолеть множество затруднений, прежде чем он нашел материал, пригодный для аппаратуры в опытах со фтором. U-образная трубка для электролиза фтористо- водородной кислоты при 55°С (охлаждаемая жидким хлористым метилом) была сделана из платины с пробками из плавикового шпата. После того как были исследованы химические и физические свойства свободного фтора, он нашел широкое применение. Сейчас фтор — один из важнейших компонентов синтеза фторорганических веществ широкого ассортимента. В русской литературе начала XIX в. фтор именовался по-разному: основание плавиковой кислоты, флуорин (Двигубский,1824), плавиковость (Иовский), флюор (Щеглов, 1830), флуор, плавик, плавикотвор. Гесс с 1831 г. ввел в употребление название фтор.
[править] Литература
- Глоссарий терминов по химии // Й.Опейда, О.Швайка. Ин-т физико-органической химии и углехимии им. Л. М. Литвиненко НАН Украины, Донецкий национальный университет — Донецк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0
- Горный энциклопедический словарь: в 3 т. / Под ред. В. С. Белецкого. — Донецк: Восточный издательский дом, 2001—2004.
| Периодическая система химических элементов Д. И. Менделеева | |||||||||||||||||||||||||||||||||||||||||||
| F | |||||||||||||||||||||||||||||||||||||||||||
| Uue | Ubn | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | ||||||||||||||||||||||||||||||||||||
| Щелочные металлы | Щёлочноземельные металлы | Лантаноиды | Актиноиды | Суперактиноиды | Переходные металлы | Другие металлы | Полуметаллы | Другие неметаллы | Галогены | Благородные газы | Свойства неизвестны | ||||||||||||||||||||||||||||||||