Послеоперационные осложнения развиваются как минимум в 10% случаев всех операций. Для этого есть несколько причин.
Во-первых, ситуация, которая сделала необходимым оперативное вмешательство, не исчезает в момент операции. Больному предстоит долгое восстановление нормального функционирования организма.
Во-вторых, само по себе хирургическое вмешательство является нефизиологическим воздействием, нарушающим многие циклические процессы в организме. Здесь и введение наркотического вещества, нагружающего печень и почки, и изменение сердечного и дыхательного ритма, кровопотеря, болевые ощущения. Экстренные и длительные операции являются закономерными факторами возникновения осложнений. В норме на 3-4-е сутки организм справляется с неожиданными обстоятельствами, и самочувствие больного улучшается.
Лечение послеоперационных осложнений требует квалифицированного подхода со стороны врачей и медицинского персонала.
Местные осложнения
В зоне операционной раны могут возникнуть следующие неприятности:
- кровотечение из-за нарушения свёртываемости крови, соскальзывания шовного материала с сосуда или недостаточного восстановления гемостаза в ходе операции. Для устранения кровотечения накладывают швы, делают повторное лигирование, помещают холод на рану или вводят гемостатические препараты;
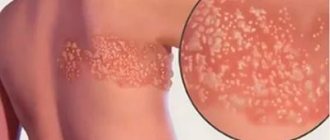
- гематома из-за кровоточащего сосуда. Гематому вскрывают, удаляют пункцией. При небольших размерах она рассасывается при УФО или наложении компресса;
- инфильтрат — отёк тканей в пределах 10 см от краёв шва вследствие инфицирования раны или образования некроза в подкожно-жировой клетчатке. В зависимости от причины для его рассасывания применяются физиотерапевтические процедуры или хирургическая обработка;
- нагноение ― инфильтрат с выраженным воспалением. Чтобы ликвидировать его, снимают швы, раскрывают края раны, промывают и устанавливают дренаж;
- эвентрация ― выпадение внутренних органов наружу из-за нагноения, непрочного ушивания краев раны, увеличения внутрибрюшного давления при кашле или метеоризме или сниженной регенерации (заживлении) тканей. Необходимо вправление органов с соблюдением асептики, строгий постельный режим и ношение тугого бандажа.
- Лигатурный свищ ― возникает при образовании абсцесса вокруг шовного материала. Требуется его иссечение вместе с шовным материалом.
Послеоперационное кровотечение
Кровотечение после хирургического вмешательства – серьезное осложнение, способное привести к летальному исходу. Поэтому такое состояние требует незамедлительной врачебной помощи.
Различают острую кровопотерю (легкая степень), синдром массивной кровопотери (средняя степень) и геморрагический шок (тяжелая степень).
Основными клиническими критериями для оценки состояния больного и степени кровопотери являются показатели гемодинамики (артериальное давление (АД), частота сердечных сокращений (ЧСС), центральное венозное давление), уровни гематокрита и гемоглобина.
Послеоперационное кровотечение может быть ранним или поздним.
Ранняя кровопотеря возникает в первые несколько часов после хирургического вмешательства. Как правило, она развивается на фоне нарушения свертываемости крови, вследствие расстройства водно-электролитного баланса или действия наркотических препаратов. Поздние кровотечения беспокоят спустя несколько суток и даже недель и обычно обусловлены занесением инфекции в рану или расхождение швов. В любом случае жизни пациента угрожает опасность и требуется неотложная медицинская помощь.
Причины послеоперационного кровотечения
- Аррозия кровеносного сосуда из-за начавшегося гнойного процесса. Такое осложнение возникает через некоторое время после проведения вмешательства.
- Расхождение швов, соскальзывание лигатуры с сосуда крупного диаметра. Наблюдается при неправильной технике наложения швов, использовании некачественного шовного материала.
- Нарушение свертываемости крови.
- Инфицирование.
Иногда развивается кровотечение из мелких сосудов, которые остались непрошитыми. Подобное возможно при снижении артериального давления во время операции, в результате чего сосуды спадаются.
Кровотечения в позднем послеоперационном периоде чаще развиваются из- за гнойного расплавления тканей в ране, распада опухолевой ткани, несостоятельности швов.
Какие существуют виды кровотечения?
- Аррозивное – при повреждении сосудистой стенки вследствие прорастания или распада новообразования, деструктивном или некротическом процессе (при отмирании тканей).
- Диапедезное – с просачиванием крови через сосудистую стенку при цинге, скарлатине, малярии.
Классификация по объему кровопотери:
- Лёгкое 10—15 % объёма циркулирующей крови (ОЦК), до 500 мл, гематокрит более 30 %
- Среднее 16—20 % ОЦК, от 500 до 1000 мл, гематокрит более 25 %
- Тяжёлое 21—30 % ОЦК, от 1000 до 1500 мл, гематокрит менее 25 %
- Массивное >30 % ОЦК, более 1500 мл
- Смертельное >50—60 % ОЦК, более 2500—3000 мл
- Абсолютно смертельное >60 % ОЦК, более 3000—3500 мл
По тому, откуда происходит кровотечение:
- Венозное – при разрыве стенки вены
- Артериальное – из артерии
- Смешанное – из разных сосудов
Какие симптомы кровотечения?
Общие признаки внутреннего кровотечения – появление слабости, потемнения или помутнения в глазах, сонливости, головокружения, холодного пота, жажды. Не исключена потеря сознания. Интенсивность кровопотери определяют по частоте пульса, показателям артериального давления и характерным жалобам пациента. Также, как правило, после операции установлен дренаж и отмечается массивное поступление крови по дренажу.
Малая кровопотеря часто никак себя не проявляет, но у некоторых незначительно учащается пульс, немного понижается артериальное давление.
Проявления кровотечения средней тяжести: ЧСС до 100 ударов в минуту, снижение показателя систолического давления до 80 мм рт. ст., умеренная одышка, сухость во рту, похолодание рук и ног, холодная испарина, головокружение, сильная слабость, замедление реакций, обморок.
При тяжелой кровопотере симптомы более выражены. Отмечают падение АД более 80 мм рт. ст., тахикардию чаще 110 ударов в минуту, одышку, дрожание рук, мучительную жажду на фоне снижения объема выделяемой мочи, апатию. Также может быть резкое побледнение слизистых и кожных покровов, синюшность конечностей и области вокруг губ, помутнение или потеря сознания.
Среди клинических проявлений массивного кровоизлияния наблюдают синюшность кожи и слизистых, спутанность сознания, бред. Западают внутрь глазные яблоки, заостряются черты лица, пульс доходит до 160 ударов в минуту, АД падает до 60 мм рт. ст.
При смертельной и абсолютно смертельной кровопотере речь идет уже об угрозе для жизни. Расширяются зрачки, появляются судороги, резко уменьшается число сердечных ударов (брадикардия) до 2–10 ударов в минуту, дыхание становится агональным, самопроизвольно выделяется моча и каловые массы. Пациент впадает в кому, кожа у него сухая, бледная с мраморным рисунком. Итог – агония, смерть.
Лечение послеоперационных кровотечений
При небольших кровотечениях бывает достаточным применение холода местно, гемостатической губки, тугой повязки. Также вводятся специальные препараты и компоненты крови с целью остановки кровотечения.
При обильных кровотечениях требуется их остановка. При кровотечениях из операционной раны требуется наложение повторно лигатуры, либо дополнительное ушивание раны.
Остановка поздних послеоперационных кровотечений нередко требует повторной экстренной операции.
https://www.facs.org/~/media/files/education/core%20curriculum/postoperative_care.ashx https://teachmesurgery.com/perioperative/general-complications/haemorrhage/ https://lektsia.com/8x2f8f.html
Общие осложнения
В результате операционного вмешательства в организме возникают системные нарушения, которые рассматриваются как послеоперационные осложнения:
- болевые ощущения. Их снимают анальгетиками, спазмолитиками и десенсибилизирующими средствами в разных комбинациях;
- расстройства нервной системы. Если больного мучает бессонница, то ему назначают снотворные и успокоительные препараты;
- послеоперационные бронхиты и пневмонии чаще появляются у курильщиков. В таких случаях назначаются антибиотики и симптоматическая терапия;
- острая сердечная недостаточность считается самым опасным осложнением, требующим проведения мероприятий по спасению больного;
- острые эмболии и тромбозы при сердечно-сосудистых патологиях, повышенной свёртываемости крови, варикозной болезни. Для предупреждения таких осложнений необходимо помещать прооперированные конечности выше уровня тела, стягивать стопы и голени эластичными бинтами, назначать терапию антикоагулянтами и дезагренантами;
- осложнения ЖКТ в виде стоматитов и сиалоаденитов (воспаления слюнных желёз) или более серьёзные последствия операции ― парез (отсутствие тонуса и перистальтики) желудка и кишечника;
- со стороны мочевого пузыря часто наблюдаются затруднение и задержка мочеиспускания. Может помочь катетеризация;
- пролежни образуются при длительном нахождении больного в одной позе в лежачем положении. Для их предупреждения нужен хороший уход за больным. При появлении пролежней их обрабатывают антисептическими растворами и ранозаживляющими средствами.
Лечение осложнений после операции является очень важным пунктом в программе реабилитации хирургического больного. Этому уделяется должное внимание со стороны врачей-хирургов в клинике «Санмедэксперт». В результате количество послеоперационных осложнений сведено к минимуму.
Виды послеоперационных рубцов
Келоидный.
Бугристый рубец из разросшейся соединительной ткани красного или синюшного цвета. На вид напоминает опухоль или шляпку гриба. Размер келоидного рубца больше самой раны, он болит, чешется, иногда пульсирует.
Гипертрофический.
Внешне похож на келоидный, но его размеры не выходят за пределы раны. Гипертрофический рубец не доставляет неприятных ощущений, со временем светлеет.
Нормотрофический.
Хорошо заживающий рубец – вначале выпуклый и покрасневший, спустя 3 месяца становится почти незаметным, чувствительность отсутствует.
Лечение длительно незаживающих послеоперационных ран промежности и анального канала
Согласно определению специального заседания Европейского общества репарации тканей, «хронической следует считать рану, не заживающую в течение периода, который является нормальным для ран подобного типа или локализации» [7]. По нашим данным, хроническим считается раневой процесс, существующий более 45 дней без признаков активного заживления.
В последнее время число больных, инфицированных микроорганизмами, передающихся половым путем, продолжает неуклонно расти. Заболевания, передающиеся половым путем (ЗППП), нередко протекают бессимптомно или малосимптомно, поэтому многие пациенты не обращаются к врачу, в этой связи половые инфекции имеют выраженную тенденцию перехода в хроническую форму [2].
В ранах промежности после оперативных вмешательств встречаются полимикробные ассоциации, представленные условно-патогенными бактериями [3], в т. ч. и клинически значимыми, в сочетании с хламидиями, трихомонадами, гарднереллами, микоплазмами, уреаплазмами, цитомегаловирусом (ЦМВ), генитальным герпесом (вирусом простого герпеса 2-го типа (ВПГ-2)), а также кандидой, т. е. возбудителями, передающимися половым путем [1, 4, 8, 11, 12].
Однако работ, посвященных данной проблеме, имеется очень немного, преимущественно они касаются гинекологической и урологической практики. В этой связи для изучения влияния инфекций, передающихся половым путем, на течение раневого процесса мы решили изучить микробиоценоз послеоперационных ран у пациентов после операций на дистальном отделе прямой кишки, анальном канале и промежности.
Было проведено исследование, целью которого являлись изучение раневого микробиоценоза и разработка комплекса специфической корригирующей терапии в послеоперационном периоде, направленной на улучшение результатов лечения больных с длительно незаживающими ранами анального канала и промежности.
Материалы и методы
Исследование проводится с сентября 2010 г. по настоящее время. В исследование было включено 96 человек, оперированных в ФБГУ «Государственный научный центр колопроктологии» по поводу свищей прямой кишки, хронических анальных трещин и геморроя.
Основную группу составили 49 пациентов с вялотекущим раневым процессом, подтвержденным при клинико-цитологическом исследовании, результатом которого явились длительно незаживающие раны (со дня операции прошло от 46 до 118 дней, в среднем – 81,3±49,3). Контрольная группа – 47 больных, у которых по данным клинико-цитологических исследований отклонений в течении раневого процесса отмечено не было, раны зажили в нормальные сроки – в среднем на 37±10,5 дня (р<0,05).
Сравнительный анализ 2-х групп пациентов не выявил существенных различий по половому и возрастному составу. Так, в основной и контрольной группах было больше мужчин – 28 (57,1%) и 29 (61,7%) соответственно. В основной группе была 21 (42,9%) женщина, в контрольной – 18 (38,3%).
Возраст пациентов основной группы колебался от 19 до 74 лет, но в большинстве своем это были люди работоспособного возраста, их средний возраст составил 41,0±13,2 года. У больных контрольной группы (лица от 18 до 72 лет) средний возраст был 42,8±12,2 года.
Также больные были сравнимы и по нозологическим формам. Среди 49 пациентов основной группы было 13 (26,5%) больных с хроническими анальными трещинами, 28 (57,1%) – со свищами прямой кишки и 8 (16,3%) – с геморроем. У большинства пациентов контрольной группы – 24 (51,1%) также диагностированы свищи, у 13 (27,7%) наблюдались трещины и у 10 (21,3%) – геморрой.
Достоверно значимых различий по характеру оперативных вмешательств также выявлено не было. В большинстве случаев у пациентов как основной, так и контрольной групп проводились оперативные вмешательства в объеме иссечения свищей в просвет прямой кишки: у 21 (42,9%) и 17 (36,2%) соответственно. Иссечение свищей с ушиванием сфинктера выполнялось у 3 (6,1%) больных основной группы и у 5 (10,6%) – контрольной. Иссечение свища с низведением лоскута проводилось у 4 (8,2%) пациентов основной группы и 2 (4,3%) – контрольной.
У 21 (42,8%) (11 мужчин и 10 женщин) больного основной группы были указания на наличие в анамнезе ЗППП и заболеваний, которые могли быть обусловлены инфекциями, передающимися половым путем, а у пациентов контрольной группы указаний на такие заболевания не было ни в одном наблюдении (р<0,001). У больных основной группы были выявлены следующие заболевания: 2 (4,1%) наблюдались у уролога по поводу хронического простатита; у 2 (4,1%) пациенток в прошлом диагностирован кольпит, при этом возбудители данного заболевания установлены не были; указание на перенесенный аднексит имело место у 1 (2,0%) больной; 1 пациенту (2,0%) проводилось лечение по поводу синдрома Рейтера; 5 мужчин (10,2%) перенесли трихомониаз; 3 пациента (6,1%) (женщина и двое мужчин) – хламидиоз; 2 пациентки (4,1%) – гарднереллез и 3 (6,1%) – кандидоз, а также 1 (2,0%) – генитальный герпес; 1 больной (2,0%) перенес в прошлом уреаплазмоз (табл. 1).
У всех больных в послеоперационном периоде проводились бактериологические и бактериоскопические исследования отделяемого ран анального канала, уретры, у женщин дополнительно – из цервикального канала: у пациентов контрольной группы – на 25–й день после операции и у пациентов основной группы – на момент обращения, а затем спустя 14 дней от начала проведенного лечения.
При помощи светового микроскопа определяли возбудителей таких инфекций, как трихомониаз, кандидоз, гарднереллез, наличие грамположительных и грамотрицательных кокков и палочек. Кроме того, для диагностики инфекций, передающихся половым путем, использовался метод полимеразной цепной реакции (ПЦР). У всех пациентов, у которых были обнаружены хламидии, микоплазмы, уреаплазмы, гарднереллы, диагноз подтверждался методом прямой иммунофлюоресценции. При выявлении ВПГ-2 и ЦМВ диагноз подтверждался с помощью культурального метода. Микробиологические исследования проводились в бактериологической лаборатории с использованием методики, позволяющей определить количественное содержание и видовой спектр аэробных и факультативно-анаэробных микроорганизмов.
У больных основной группы сразу после обращения по поводу длительно незаживающей раны (на 46–118-й день), а затем через 14 дней от начала лечения проводились цитологические и патоморфологические исследования отделяемого из послеоперационных ран. У пациентов контрольной группы эти исследования проводили на 25-й день после операции.
Результаты
При цитологическом исследовании во время обращения по поводу длительно незаживающей раны у 45 (91,8%) больных основной группы наблюдалась картина «извращенной» репарации – наличие многоядерных клеток типа инородных тел в мазках-отпечатках из ран, а также у всех 49 пациентов – хронический воспалительный процесс с большим количеством неизмененных лейкоцитов. Количество лейкоцитов в ранах от 30 до 40 в поле зрения наблюдалось у 8 (16,3%) больных, 40–60 – у 7 (14,3%), 60–80 – у 9 (18,4%), все поле зрения –у 25 (51%) пациентов. К 25-му дню у всех больных контрольной группы лейкоциты с явлениями дистрофии были в небольшом количестве и не превышали 5 в поле зрения (р<0,001).
Данные цитологического исследования коррелировали с данными, полученными при патоморфологическом исследовании. У пациентов основной группы в биоптате обнаружено большое количество неизмененных нейтрофилов, микрофлора локализуется как вне-, так и внутриклеточно; явления фагоцитоза слабо выражены. У больных контрольной группы в биоптате выявлялись единичные, дистрофически измененные лейкоциты, а также макрофаги и фибробласты.
При микробиологическом исследовании в момент обращения (на 46–118-й день после операции) у всех 49 (100%) больных основной группы в отделяемом послеоперационных ран определялись различные микроорганизмы; у пациентов контрольной группы на 25-й день после операции в 44 (93,6%) из 47 наблюдений были выявлены какие-либо микроорганизмы, а у 3 (6,4%) из них отсутствовал рост в бактериальных посевах.
У пациентов основной группы среди микроорганизмов преобладали Enterococcus faecalis (фекальные стрептококки) – у 28 (57,1%), а также Escherichia coli (кишечная палочка) – у 20 (40,8%); первые встречались более чем в 4 раза чаще, вторые – в 6 раз чаще, чем у больных контрольной группы. Enterobacter cloacae (энтеробактер) в 11 раз чаще обнаруживался у пациентов основной группы по сравнению с больными контрольной (этот микроорганизм обнаружен лишь у 1 больного контрольной группы). Candida albicans (дрожжевой грибок) высевался у 14 (28,6%) пациентов основной группы и у 9 (19,1%) – контрольной.
У пациентов основной группы в бактериальных посевах из послеоперационных ран такие клинически значимые микроорганизмы, как Proteus mirabilis (протей), были обнаружены в 10 (20,4%), Acinetobacter lwoffii (ацинетобактер) – в 4 (8,2%), Staphylococcus aureus (золотистый стафилококк) – в 10 (20,4%), Streptococcus haemolyticus (гемолитический стрептококк) – в 3 (6,1%) наблюдениях. Суммарно частота выявления этих клинически значимых условно-патогенных микроорганизмов у больных основной группы составила 27 (55,1%) случаев, количество микроорганизмов превышало 105 КОЕ. У пациентов контрольной группы клинически значимые микроорганизмы обнаруживались только у 1 (2,1%) пациента (высевался Staphylococcus aureus), микробное число в данном случае составило 105 КОЕ (р<0,001).
Ассоциации микроорганизмов в бактериальных посевах встречались у 47 (95,9%) пациентов основной группы: 5 различных возбудителей обнаружено у 5 (10,2%), 4 – у 5 (10,2%), 3 – у 5 (10,2%), 2 – у 32 (65,3%) больных; тогда как в контрольной группе – лишь у 4 (8,5%) пациентов была выявлена ассоциация 2-х микроорганизмов (р<0,001) (табл. 2).
У всех пациентов основной группы с длительно незаживающими ранами были выявлены различные микроорганизмы, передающиеся половым путем, из них у 98% пациентов обнаружены патогенные возбудители ЗППП, тогда как в контрольной группе этот показатель составил лишь 23,4% (у 11 из 47 больных), при этом все обнаруженные микроорганизмы – возбудители ЗППП у последних были условно-патогенными (р<0,01) (рис. 1).
У 26 (53,1%), т. е. более половины пациентов основной группы, в раневом отделяемом обнаруживались хламидии. При этом Chlamydia trachomatis только у 3 (6,1%) больных была обнаружена также и в уретре, и в цервикальном канале у женщин. В контрольной группе хламидиоз не диагностирован (р<0,001).
Трихомонада была выявлена более чем у трети пациентов основной группы – в 19 (38,8%) случаях: у 2 (4,1%) пациенток в отделяемом из ран, а также уретры, анального и цервикального каналов и у 2 (4,1%) мужчин – в уретре и отделяемом из ран, а у 15 (30,6%) больных – только в отделяемом из послеоперационных ран. В контрольной группе трихомониаз не был обнаружен (р<0,001).
Гарднерелла определялась у 17 (34,7%) пациентов основной группы: у 8 (16,3%) из них этот микроорганизм обнаруживался во всем исследуемом материале, у 9 (18,4%) – только в раневом отделяемом. У 7 (14,9%) пациентов контрольной группы данный микроорганизм выявлялся в 5 (10,6%) наблюдениях во всем исследуемом материале, в 2 (4,3%) – только в отделяемом из уретры и цервикального канала.
Кандида выявлялась в 29 (59,2%) случаях у пациентов основной группы в отделяемом из анального канала, уретры, цервикального канала и послеоперационных ран. В контрольной группе кандидоз был обнаружен у 5 (10,6%) человек также во всем исследуемом материале (р<0,001).
Несколько реже встречались такие внутриклеточные микроорганизмы, как уреаплазма и микоплазма. У 6 (12,2%) пациентов основной группы уреаплазма обнаруживалась во всем исследуемом материале, тогда как в контрольной группе этот микроорганизм определялся у 1 (2,1%) больного только в отделяемом из уретры (р<0,05). В 1 (2,0%) случае у больной основной группы была диагностирована Мycoplasma hominis, которая определялась в отделяемом послеоперационных ран и анального канала. У 1 (2,1%) больного контрольной группы Мycoplasma hominis была обнаружена в отделяемом послеоперационной раны и уретры.
У 6 (12,2%) пациентов основной группы выявлен ВПГ-2: у 3 (6,1%) в материале из уретры, цервикального канала и послеоперационных ран и у 3 (6,1%) только в отделяемом из ран. В контрольной группе ВПГ-2 не встречался (р<0,05).
ЦМВ обнаружен у 10 (20,4%) больных основной группы: у 9 (18,4%) в анальном канале и раневом отделяемом и у 1 (2,0%) пациента в уретре, цервикальном канале и раневом отделяемом; тогда как в контрольной группе – не выявлен ни в одном наблюдении (р<0,001).
Частота выявления трихомонады у больных основной группы только из отделяемого из послеоперационных ран при отсутствии их в отделяемом из гениталий составила 30,6% (в 15 наблюдениях), хламидии – 46,9% (в 23 наблюдениях), ЦМВ – 18,4% (в 9 наблюдениях) и ВПГ-2 – 6,1%. Этот факт свидетельствует о длительно существующем хроническом процессе, при котором бывает трудно обнаружить возбудителей ЗППП, если нет какого-либо провоцирующего фактора. Поскольку возбудители хронической инфекции, передающейся половым путем, находятся в эпителиальной клетке в неактивном, «дремлющем» состоянии, появление раны в области промежности либо анального канала является тем самым провоцирующим фактором, который позволяет хронической латентной инфекции активизироваться.
Возбудители ЗППП у всех 49 пациентов основной группы, у которых они были диагностированы, ни в одном наблюдении не встречались как моноинфекция, а обнаруживались только в ассоциациях с другими возбудителями ЗППП. Наличие сразу 2-х микроорганизмов, вызывающих ЗППП, обнаружены у 33 (67,3%) больных, а у 16 (32,7%) пациентов основной группы встречалось сочетание 3-х возбудителей.
У 11 больных контрольной группы, у которых были выявлены микроорганизмы, передающиеся половым путем, напротив, наиболее часто встречался 1 возбудитель – у 8 (17,0%), сочетание 2-х микроорганизмов выявлено у 3 (6,4%) пациентов, а наличие сразу 3-х и более микроорганизмов ни в одном наблюдении обнаружено не было (р<0,001).
У пациентов основной группы частота обнаружения ассоциаций микроорганизмов составила: трихомонада, ЦМВ и кандида – 10,2% (5 больных); хламидия, трихомонада и кандида – 8,2% (4 пациента); трихомонада, гарднерелла и кандида – 10,2% (5 больных); хламидия и гарднерелла – 20,4% (10 наблюдений); хламидия и кандида – 14,3% (7 больных); трихомонада и кандида – 8,2% (4 случая). У 3 (6,4%) больных контрольной группы кандида встречалась в сочетании с гарднереллой.
Среди ассоциаций условно-патогенных микроорганизмов с возбудителями ЗППП у пациентов основной группы встречались сочетания: золотистого стафилококка с трихомонадой, хламидией и кандидой – у 4 (8,2%) больных; протея с трихомонадой и кандидой – у 3 (6,1%); протея с хламидией и кандидой – у 6 (12,2%). Как уже указывалось, золотистый стафилококк обнаруживался в посеве только у 1 (2,1%) пациента контрольной группы и ассоциировался с кандидой.
Гемолитические стрептококки ассоциировались с энтерококками, хламидией, кандидой и ВПГ-2 у 2 (4,1%) больных, в ассоциации с хламидией и кандидой – у 1 (2,0%) пациента основной группы.
Таким образом, условно-патогенные, клинически значимые микроорганизмы часто ассоциируются с патогенными микроорганизмами, к которым относятся трихомонада, хламидия, ЦМВ и ВПГ-2. Можно сказать, что патогенные микроорганизмы, передаваемые половым путем, создают благоприятные условия для размножения условно-патогенных микроорганизмов, таких как золотистый стафилококк, протей, гемолитический стрептококк и др., что в свою очередь приводит к длительному поддержанию воспалительной раневой реакции и замедлению процессов репарации в ранах.
Всем больным с длительно незаживающими ранами, у которых обнаружены ЗППП, была назначена соответствующая терапия в зависимости от выделенного возбудителя.
При хламидиозе назначались антибиотики с учетом того, что антихламидийный агент должен активно воздействовать на делящиеся ретикулярные тельца. К таким антибиотикам относятся: макролиды (рокситромицин, кларитромицин, джозамицин), тетрациклины (тетрациклин, доксициклин), эритромицин, фторхинолоны (ципрофлоксацин, офлоксацин).
При микоплазмозе и уреаплазмозе пациенты получали антибиотики из следующих групп: макролиды (рокситромицин, клатритромицин, джозамицин), тетрациклины (тетрациклин, доксициклин), фторхинолоны (ципрофлоксацин, офлоксацин), линкозамины (линкомицин, клиндамицин), аминогликозиды (гентамицин, стрептомицин).
При трихомониазе и гарднереллезе использовались препараты, обладающие противопротозойным и противомикробным действием: метронидазол, тинидазол, орнидазол.
Лечение кандидоза проводилось антимикотическими препаратами из групп триазола (флуконазол, итраконазол), имидазола, полиена (нистатин, леворин, амфотерицин В), аллиламина, эхинокандина (каспофунгин).
При генитальном герпесе назначались интерферон и соединения, обладающие интерферониндуцирующей активностью; ингибиторы репликации вирусной нуклеиновой кислоты (аналоги нуклеозидов (ацикловир), аналоги пирофосфата (фоскарнет натрий)).
При ЦМВ-инфекции назначались ингибиторы репликации вирусной нуклеиновой кислоты: ганцикловир, аналоги пирофосфата (фоскарнет натрий), экстракт побегов картофеля.
Всем больным в комплексе с этиотропными препаратами назначались пробиотики для восстановления нормальной флоры ЖКТ.
В результате проведенного лечения отмечено выздоровление всех пациентов с длительно незаживающими ранами, вошедших в основную группу, которое подтверждалось при клиническом, цитологическом и патоморфологическом исследованиях.
Клинический пример: пациентка В., оперированная по поводу чрессфинктерного свища прямой кишки. По поводу длительно незаживающей раны обратилась на 56-й день после операции. В области раны определялись гипергрануляции, которые при контакте легко кровоточили, на отдельных участках рана была покрыта фибрином (рис. 2).
При ПЦР и бактериоскопическом исследовании отделяемого из раны обнаружены трихомонада, хламидия и кандида. Через 3 нед. после проведенной специфической терапии, направленной на элиминацию выявленных инфекционных агентов, рана зажила полностью.
Клинический пример: пациент К., оперирован по поводу экстрасфинктерного свища прямой кишки. На 108-й день после операции при клиническом осмотре – обильное отделяемое из раны слизисто-гнойного и слизисто-сукровичного характера (рис. 3).
Данные клинического обследования коррелировали с цитологическими (рис. 4) и патоморфологическими (рис. 5) исследованиями. При ПЦР и бактериоскопическом исследовании отделяемого из раны обнаружены ЦМВ, ВПГ-2 и кандида. После проведенного этиотропного лечения (противовирусная терапия, антимикотические препараты) рана зажила полностью.
Заключение
1. У больных с длительно незаживающими послеоперационными ранами в анамнезе частота выявленных мочеполовых инфекций и заболеваний, возможно, обусловленных ЗППП, была 42,8%, тогда как у больных контрольной группы анамнестических указаний на перенесенные ЗППП не было (р<0,001).
2. При цитологическом исследовании в мазках-отпечатках из ран у 91,8% больных основной группы наблюдалась картина извращенной репарации. У всех больных контрольной группы к 25-му дню лейкоциты обнаружены лишь в небольшом количестве (до 5 в поле зрения), с явлениями дистрофии (р<0,001).
3. Частота обнаружения таких клинически значимых микроорганизмов, как протеи, гемолитические стрептококки, золотистые стафилококки, ацинетобактер у больных основной группы составила 55,1%. И лишь у 1 (2,1%) больного контрольной группы высеялся золотистый стафилококк (р<0,001). Ассоциации микроорганизмов в бактериальных посевах были обнаружены у 95,9% пациентов основной группы, тогда как в контрольной группе – лишь у 8,5% больных (р<0,001).
4. У всех пациентов основной группы с длительно незаживающими ранами были выявлены различные ЗППП, в т. ч. у 98% – облигатные патогенные микроорганизмы. У 23,4% больных контрольной группы обнаруженные микроорганизмы, передающиеся половым путем, являлись лишь условно-патогенными (р<0,01).
5. У большинства больных с длительно незаживающими ранами трихомонады (30,6%), хламидии (46,9%) и ЦМВ (18,4%), герпесвирусы (6,1%) выявлялись только в отделяемом из ран и не были обнаружены в соскобах из гениталий. Наличие в области промежности либо анального канала раневого дефекта является провоцирующим фактором, который позволяет хронической, латентной инфекции активизироваться.
6. Клинически значимые условно-патогенные микроорганизмы (протей, ацинетобактер, гемолитический стрептококк и золотистый стафилококк) наиболее часто ассоциируются с патогенными микроорганизмами, передающимися половым путем, к которым относятся трихомонады, хламидии, ЦМВ и ВПГ-2.
Введение
Прогресс трахеальной хирургии, как и какой-либо другой хирургической специальности, неразрывно связан с обеспечением безопасности лечения во время и после операции. Это достигается многокомпонентным способом и касается обследования, адекватного выбора варианта операции, анестезиологического обеспечения, а также непосредственно самой техники хирургического вмешательства и правильного ведения послеоперационного периода. Погрешность относительно какого-либо из этих компонентов грозит развитием грозных и даже фатальных осложнений. Наиболее тяжелыми из них являются сосудистые осложнения. Они могут иметь различный характер, локализацию и тяжесть. Хирургической безопасности операций на трахее были посвящены многие исследования [3, 4, 6—8, 10, 14, 17, 19, 20, 22, 24]. За годы становления трахеальной хирургии удалось достигнуть существенного прогресса в этом вопросе. В условиях специализированных высококвалифицированных медицинских учреждений эти операции стали довольно безопасными. Частота послеоперационных осложнений и госпитальная летальность значительно снизились. Были изучены спектр осложнений, их этиопатогенез и предложены мероприятия по профилактике. В структуре послеоперационных осложнений в трахеальной хирургии наиболее грозными являются сосудистые осложнения, особенно аррозионное кровотечение из крупных артериальных сосудов. Они служат основной причиной госпитальной летальности.