Установка имплантов эффективно решает проблему отсутствия зубов во рту и является современной альтернативой классическому протезированию. При проведении имплантации в кость челюсти вживляются специальные конструкции — дентальные импланты. Они заменяют собой естественные корни зубов и выступают опорой для коронок и протезов. При вживлении имплантов в челюстную кость важно добиться хорошей первичной стабильности искусственного корня, а для этого требуются определенные показатели состояния костной ткани — она должна быть плотной, иметь достаточную высоту. Если объем кости, ее ширина или высота успеют «уйти» — потребуется предварительное наращивание костной ткани. В этой статье нашего сайта мы подробно расскажем вам о наращивании костной ткани перед имплантацией зубов: рассмотрим материалы, применяемые для восстановления параметров кости, методики проведения наращивания, цены на услугу в Москве.
Пройдите короткий тест и рассчитайте стоимость лечения!
Пройти короткий тест
Причины, по которым возникает необходимость в наращивании костной ткани перед имплантацией
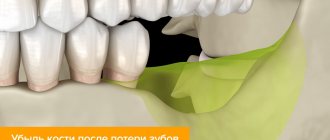
Почему же возникает необходимость в наращивании костной ткани на челюсть перед установкой имплантов? Дело в том, что корни естественных зубов человека находятся в особенном отделе челюстной кости, который стоматологи называют альвеолярным отростком. У каждого человека параметры альвеолярных отростков индивидуальны, так как на них влияет целый ряд факторов: например, степень жевательной нагрузки, наличие патологий эндокринной системы, болезней костей и суставов.Однако в 99 % случаев атрофия костной ткани вызывается отсутствием жевательной нагрузки в области удаленного зуба. Пока такая нагрузка присутствует, костная ткань в области альвеолярных отростков сохраняет здоровый тонус, но без нее начинает постепенно атрофироваться.
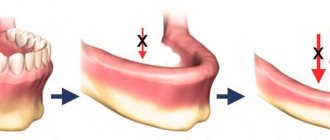
Уже через пару месяцев после потери зуба кость успевает утратить свою плотность и первоначальную высоту и тогда проведение имплантации без предварительного наращивания костной ткани будет невозможным.
У разных людей атрофия костной ткани развивается по-разному, у кого-то быстрей, у кого-то чуть медленнее. Темпы развития атрофии зависят и от области расположения дефекта: на нижней челюсти она развивается достаточно медленно, а вот в зоне верхней челюсти патологический процесс протекает стремительно. Поэтому если у вас нет желания делать впоследствии наращивание кости – при потере зуба срочно задумывайтесь об его восстановлении!
ПОЛЕЗНО УЗНАТЬ: Съемное протезирование атрофию кости не прекращает и даже наоборот – ускоряет ее. Если вы хотите обойтись без наращивания костной ткани, стоит не тянуть с реставрацией зубов и сразу после удаления зубной единицы планировать имплантацию.
При атрофии кость может терять и плотность и высоту, уменьшаться по ширине. В зависимости от вида атрофии, степени ее развития, области установки имплантов выбирается техника и материалы для проведения наращивания костной ткани при имплантации зубов.
Барьерные мембраны.
Я должен заметить, что это наиболее часто используемые в нашей практике биоматериалы. И вот, почему.
У остеографтов, рассмотренных в предыдущей части, простое и понятное назначение – заполнение и удержание объема. Но ведь объем мы можем заполнить чем-нибудь другим – аутокостной стружкой, костным блоком, сформировать его пластиной, сеткой, тентовыми винтами или вообще ничем не заполнять. Так уж устроен наш организм – свято место в нём пусто не бывает, и поэтому довольно скоро сформированное нами пространство для регенерации заполнится…. увы, но не желанной костной тканью.
Это происходит потому, что все ткани нашего организма регенерируют с разной скоростью.
Например, вы случайно порезали пальчик, из него даже кровь идёт.
провели гигиеническую обработку ранки – промыли, заклеили пластырем. Через сутки в ране образуется твердый тромб, затем первичный рубец – и пластырь можно снять. А еще через неделю-две, вы сможете спокойно ковырять этим пальчиком где угодно, без риска повредить новую кожу и вызвать кровотечение. Через месяц-два вы вряд ли сходу найдёте след от пореза. А через полгода – уже точно не найдёте.
Совершенно иная ситуация, если вы палец не порезали, а не дай Б-г, сломали.
В травмпункте вам сделают снимки, репозицию (если нужно) и наложат гипс недели на три. Таким образом, палец и область перелома обездвиживаются (это необходимое условие для регенерации кости) на время заживления перелома, а более-менее внятную функциональную нагрузку, без риска осложнений,на сломанный палец можно будет дать, минимум, через месяц-полтора. Потому что костной ткани, из-за особенностей её питания и метаболизма, требуется значительно больше времени на восстановление, нежели мягким тканям.
Фактически, те же самые процессы происходят в области остеопластической операции. То пространство, которое мы только что сформировали, быстро заполнится мягкими тканями – и костной ткани уже некуда будет расти. Поэтому совершенно логичным и правильным выглядит разделение тканей с разной скоростью регенерации:
Как раз для этого и предназначены барьерные мембраны.
Материалы для наращивания костной ткани в стоматологии
Наращивание костной ткани перед имплантацией зубов подразумевает применение разных видов остеопластических материалов. Остеопластики бывают синтетическими и натуральными, каждый вид имеет свои особенности и характеристики, от разновидности остеопластического материала зависит цена наращивания костной ткани и сроки восстановления после операции. Какие же виды остеопластиков для наращивания костной ткани десны при имплантации вам могут предложить в современной стоматологии?
Аутогенные остеопластики для наращивания
Так называют костный материал биологического происхождения, который получают непосредственно у пациента. Донорский остеопластик забирается с определенных участков челюсти или подбородка. Процесс получения донорской кости болезненный и травматичный, однако биоматериал быстро приживается, при его применении не возникает осложнений и негативных реакций иммунной системы.
Аллогенные материалы
Донором кости для наращивания зубной костной ткани выступает другой человек, а не сам пациент. Такой вид остеопластиков забирают у доноров, умерших или погибших, подвергают специализированной и сложной обработке и помещают в банки донорских тканей. Кому-то такой способ получения костного материала может показаться неэтичным, однако, использование аллогенных остеопластиков позволяет снизить риски отторжения кости, избавляет от необходимости в заборе материала непосредственно у пациента, а значит и снижает травматичность операции в целом.
Ксеногенные остеопластики для наращивания костной ткани на зубах
Этот вид остеопластического материала получают из свиной или бычьей кости. Он выпускается в виде блоков или же гранул. Ксеногенные остеопластики приживаются достаточно хорошо, но все – таки хуже, чем аллогенные и аутогенные материалы.
Аллопластические остеопластики
Гранулированный синтетический остеоматериал, производимый из фосфата кальция. Основное его преимущество — доступная цена, снижающая стоимость наращивания костной ткани.
Отдельным видом остеопластиков, применяемых при наращивании костной ткани являются коллагеновые мембраны, которые изолируют костный дефект и активизируют процессы прироста естественной кости челюсти.
Вместо пролога. Что такое биоматериалы?
С точки зрения толкового словаря, под биоматериалами подразумеваются любые чужеродные вещества и объекты, внедряемые в организм и дополняемые его структурно или/и функционально, и использующиеся в медицинских целях. То есть, биоматериалами можно назвать искусственные клапаны сердца, эндопротезы, имплантаты, в т. ч. дентальные, металлоконструкции, применяемые при остеосинтезе, гемостатические средства, зубные протезы, коронки, вкладки, пломбы и т. д. И наоборот, сережки для пирсинга, краски для татуировок, всякие страшные штуки для боди-моддинга к биоматериалам, в правильном их понимании, не относятся.
То, что мы используем для “наращивания костной ткани”, было бы правильнее назвать “биоматериалами для регенеративной хирургии”, что конкретизирует и объясняет их назначение. В общих чертах, современный стоматологический рынок предлагает нам три категории таких материалов – остеографты, барьерные мембраны и мукографты:
Чуть позже, мы подробно рассмотрим каждую из этих категорий.
Говорить о показаниях и противопоказаниях к использованию биоматериалов с точки зрения пациента достаточно сложно, поэтому их использование в ходе тех или иных остеопластических операций – вопрос, относящийся больше к конкретной методике, нежели к самому материалу. Поэтому мы будем рассматривать его в статьях, посвященных определенным методикам остеопластики. То есть, скоро.
Но, в целом, уважаемые друзья, вам нужно знать следующее:
– использование биоматериалов – это всегда компромисс, вынужденная мера.
Да, теоретически и практически, мы могли бы обходиться без них. И тому есть масса примеров:
уточню, что на двух правых снимках – временная коронка на установленном имплантате. Биоматериалы для остеопластики в данном клиническом случае не применялись.
Но в таких случаях мы сталкиваемся с проблемой – если нам необходимо возместить атрофическую утрату кости или слизистой оболочки, то её необходимо где-то взять. И нередко процесс получения аутотрансплантата (т. е., собственного фрагмента тканей для пересадки) увеличивает травматичность, сложность и продолжительность хирургического вмешательства. А иногда вообще является отдельной хирургической операцией со всеми вытекающими: повышаются риски осложнений и снижается безопасность хирургического лечения. Совершенно логичным выглядит желание всего этого избежать, заменив аутотрансплантат чем-то “искусственным”.
– ни один из существующих биоматериалов не улучшает качество регенерирующих тканей.
Это микроскопная фотография того, что получается после остеопластики с использованием биоматериалов.
Если мы говорим, к примеру, о “наращивании костной ткани”, то ни один из остеографтов, используемых в современной хирургической практике, не делает кость крепче, прочнее, красивее и т. д. Более того, то, что мы получаем в результате использования “искусственных заменителей кости”, сложно назвать костью в биологическом смысле – скорее, это костная мозоль с включением частиц биоматериала(как на микроскопной картинке выше), её свойства и структура сильно отличаются от нормальной здоровой костной ткани. Если уж говорить совсем серьезно, то использование графтов “ухудшает” качество тканей. Но мы вынуждены идти на этот компромисс, чтобы восполнить их объем и, соответственно, создать условия для нормальной имплантологической реабилитации.
– не существует биоматериалов, ускоряющих регенерацию тканей.
Я бы даже сказал больше – от марки, производителя или страны происхождения биоматериала мало, что зависит. Все существующие в мире графты и барьерные мембраны работают одинаково, по одним и тем же биологическим законам. Категорически неправильно утверждать, что “этот материал работает лучше, чем этот” или “вот этот хороший, а этот – полное говно!”. Безусловно, биоматериалы отличаются между собой целым рядом свойств, и сегодня мы с вами обязательно поговорим об этих свойствах.
– у каждой из категорий биоматериалов есть своё назначение и чётко прописанная функция.
Прямо как на этой картинке:
Использовать биоматериалы не по назначению – это, как минимум, серьезно рисковать результатом. Например, мы можем попытаться с использовать гемостатическую губку для заполнения субантрального пространства при синуслифтинге. И, возможно, мы даже получим хороший результат. Но, только слово “возможно” меня лично очень смущает. В хирургии использование этого слова должно быть сведено к минимуму.
– использование биоматериалов должно быть обоснованным и понятным, прежде всего, вам.
“Сюда засунем, здесь приколотим” … иными словами, использование графтов и барьерных мембран, – это всегда отличный способ завысить стоимость лечения или искусственно усложнить предстоящую операцию. И действительно, установленные имплантаты можно пересчитать, по контрольным снимкам легко определяется их марка и модель, а вот определить объем де-факто использованного при синуслифтинге графта или размер установленной барьерной мембраны (да и вообще, наличие этой самой мембраны) не так уж и просто. Если вы по каким-то причинам не понимаете, для чего необходимо использование биоматериалов в вашем клиническом случае, значит, они не нужны. Об их применении в различных клинических ситуациях мы поговорим в последующих статьях, когда будем изучать каждый из существующих методов остеопластики. Ну и, после операции имеет смысл “свериться” с реальным расходом биоматериалов – все графты и барьерные мембраны используемые в современной хирургии, имеют специальные наклейки с указанием их параметров и серийных номеров, – одна наклейка остаётся в медицинской карте, вторая вклеивается в договор, на контрольный снимок или специальный бланк, которые передаются пациенту.
Наконец, последнее, от того не менее важное:
все существующие биоматериалы – одноразовые. Одна упаковка предназначена ТОЛЬКО для одной операции:
Это, собственно, значит, что во-первых, неиспользованные остатки биоматериалов нельзя повторно стерилизовать и использовать, а во-вторых, что отсутствие вышеуказанной наклейки говорит о том, что в вашем лечении, возможно, был использован “левый” материал или остатки с какой-то другой операции. Категорически не рекомендую на этом экономить, ибо правильно простерилизовать уже открытый материал в условиях обычной стоматологической клиники без потери его свойств невозможно.
В принципе, уважаемые друзья, знания вышеперечисленного вполне достаточно, чтобы понять, нужны ли недешевые, в общем-то, биоматериалы для наращивания костной ткани конкретно в вашем клиническом случае. На всякий случай напоминаю, что
если вы чего-то не понимаете, – значит вам это не нужно.
Вспомните, хотя бы, вот эту статью>>.
В рамках семинаров RegenerationDay by Geistlich, мне удаётся не только повысить чувство собственной важности, но и побеседовать с докторами из различных клиник, городов и регионов нашей страны. И я не могу не замечать зловредную тенденцию – чрезмерное злоупотребление биоматериалами, бестолковое желание затолкать их туда, где они, в принципе, не нужны. Многие в них видят какую-то панацею, некую “волшебную таблетку”, способную, если не гарантировать, то улучшить результат любой остеопластической операции. Увы, это не так.
В нашем стоматологическом центре делается очень много остеопластических операций – больше двухсот с начала года. При этом, расход биоматериалов относительно небольшой – они используются меньше, чем в половине случаев. Почему? Для ответа на этот вопрос нужно, как минимум, прочитать вот это>> или просто заглянуть к нам в клинику на консультацию.))
Обзор способов наращивания кости челюсти
Наращивание костной ткани перед установкой имплантов зубов может быть проведено по одной из четырех технологий, которые мы детально опишем в этом разделе нашей статьи.
Наращивание костной ткани при имплантации расщеплением альвеолярного отростка
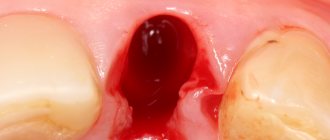
При проведении операции альвеолярный отросток, в области в которой требуется нарастить костную ткань перед имплантацией, распиливается специальной стоматологической фрезой. Полученное отверстие врач расширяет и углубляет сверлами разного диаметра. После этих манипуляций в подготовленное ложе ставятся импланты, а оставшиеся пустоты заполняют синтетическим костным наполнителем и накрывают коллагеновой мембраной.
Рану ушивают и пациента отправляют домой. Абатменты и коронки на импланты устанавливают примерно через 4-6 месяцев после операции наращивания костной ткани, совмещенной с имплантацией. Этот перерыв в лечении необходим для прироста естественной кости и приживления установленных искусственных корней.
Рассматриваемая методика наращивания костной ткани при имплантации чаще всего применяется при необходимости установки сразу нескольких имплантов и при горизонтальной резорбции альвеолярной отростка, при которой кость сохранила толщину не менее чем в два миллиметра. Плюсами технологии можно назвать возможность совмещения операции с установкой имплантов, сжатые сроки регенерации кости челюсти, отсутствие необходимости в использовании дорогостоящего биологического костного материала.
Цена на наращивание костной ткани в Москве методом расщепления альвеолярного отростка начинается от 40 тысяч рублей. В указанную сумму не входит стоимость установки имплантов.
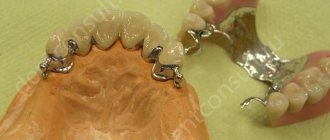
Подсадка костных блоков для наращивания кости
Показания и противопоказания к операции
Показания:
- Недостаток объема кости при необходимости имплантации. Часто остеопластику выполняют одновременно с имплантацией
- Косметические дефекты, вызванные убылью размера челюстей (формирование глубоких морщин в области губ)
- Посттравматическая атрофия
- Генерализованная форма пародонтита
Противопоказания:
- Иммунные заболевания
- Онкология
- Нарушение свертываемости крови
- Любые болезни в острой стадии или фазе обострения
- Беременность и грудное вскармливание (разрешено лишь при одобрении гинеколога во втором триместре)
- Тяжелые патологии сердечно-сосудистой системы
- Сахарный диабет в стадии декомпенсации
- Эпилепсия и психические расстройства
- Заболевания лор-органов (до полного излечения)
Возможные осложнения после костной пластики
Даже использование современных технологий не дает абсолютной гарантии от возможных негативных последствий костной пластики.
После процедуры некоторые пациенты могут столкнуться со следующими проблемами:
- Появление отеков в течение нескольких суток — естественная защитная реакция организма на хирургическое вмешательство.
- Кровотечение — нормальное явление сразу после операции. Если не прекращается в течение нескольких суток, то причиной могут служить ослабившие швы или врачебная ошибка. В этом случае обязательно рекомендуется обратиться к врачу.
- Появление боли в шейном отделе — результат длительной анестезии. Достаточно размять шею и не допускать сильных физических нагрузок.
- Ощущение онемения в области челюсти — в первые 2-3 суток это нормальное явление. Если онемение ощущается более длительный период, возможно, произошло повреждение нерва. Нужно обязательно обратиться к врачу.
Если дискомфорт не проходит в течение длительного времени (более 72 часов) — это может говорить о первом признаке отторжения, рекомендуется незамедлительно обратиться в больницу, желательно к врачу, который проводил операцию.
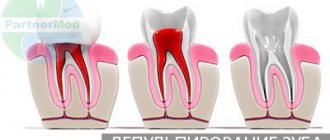
Разновидности
Всего костная ткань имеет два типа, все зависит от микроскопического ее строения. Первая называется ретикулофиброзной или грубоволокнистой, вторая — пластинчатой. Рассмотрим каждую в отдельности.
У эмбриона, новорожденного
Ретикулофиброзная широко представлена у эмбриона, ребенка после появления на свет. У взрослого же человека много соединительной ткани, а эта разновидность встречается только в месте, где сухожилие прикреплено к кости, в месте соединения швов на черепе, в линии перелома. Постепенно ретикулофиброзная ткань заменяется пластинчатой.
Имеет эта костная ткань особое строение, ее клетки расположены неупорядоченно в межклеточном веществе. Коллагеновые волокна, являющиеся разновидностью соединительной ткани, мощные, плохо минерализованы, направление имеют различное. Ретикулофиброзная кость имеет большую плотность, но клетки не имеют ориентации по соединительной ткани коллагеновых волокон.
У взрослого
Когда младенец вырос, его кость содержит в основном пластинчатую костную ткань. Эта разновидность интересна тем, что минерализованным межклеточным веществом образованы костные пластинки, имеющие толщину от 5 до 7 мкм. Любая пластина состоит из коллагеновых волокон соединительной ткани, расположенных параллельно, максимально близко, а также пропитанных кристаллами специального минерала – гидроксиаппатита.
В соседних пластинах волокна соединительной ткани проходят под разным углом, это обеспечивает прочность, к примеру в бедре или челюсти. Лакуны или альвеолы между пластинами в упорядоченном порядке содержат клетки кости – остеоциты. Их отростки по канальцам проникают в рядом расположенные пластины, за счет чего образуются межклеточные контакты соседних клеток.
Есть некоторые системы пластинок:
- окружающие (наружные или расположенные изнутри);
- концентрические (входящие в структуру остеона);
- вставочные (остаток разрушающегося остеона).
Строение кортикального, губчатого слоя
В основе этого слоя находятся минеральные соли, в челюсти именно сюда через альвеолы вживляются импланты. Базальный слой расположен наиболее глубоко, является наиболее прочным, есть в челюсти много перегородок, пронизанных капиллярами, их же немного.
В центральном отделе находится губчатое вещество, в его строении есть некоторые тонкости. Построено оно из перегородок, капилляров. За счет перегородок кость имеет плотность, а по капиллярам она получает кровь. Их функции в челюсти заключаются в питании зубов, насыщении кислородом.
В костях организма, в том числе челюсти, которая содержит альвеолы, есть компактное, а потом следующее за ним губчатое вещество. Обе эти составляющие имеют несколько разное строение, но образованы тканью пластинчатого типа. Компактное вещество расположено снаружи, к нему идет прикрепление мышечной, хрящевой или соединительной ткани. Его функции сводятся к тому, чтобы придать кости плотность, как, к примеру, на челюсти, альвеолы которой несут нагрузку от пережевывания пищи.
Губчатое вещество расположено внутри любой кости, в том числе челюсти, в нижней части его содержат альвеолы. Его функции сводятся к дополнительному укреплению кости, в придании ей пластичности, эта часть является вместилищем костного мозга, который продуцирует клетки крови.
А что на практике?
Знание принципов и закономерностей атрофического процесса, с одной стороны, рвёт шаблон и наше представление об остеопластике, но с другой – предоставляет весьма достоверный прогностический инструмент. С помощью него можно не только предсказать динамику изменения объёмов костной ткани после удаления и имплантации, но и внятно объяснить, в разных клинических условиях работают разные методы наращивания костной ткани.
Что мы знаем о пациенте?
Биотип костной ткани – это то, что мы можем определить по компьютерной томограмме еще до удаления зуба.
Как это использовать?
Зная взаимосвязь между биотипом и атрофией, можно более-менее достоверно определять показания, к примеру, для превентивной консервации лунки, в том числе, при немедленной имплантации.
И, по идее, такой внятный анализ и прогноз атрофии применительно к конкретному клиническому случаю должны заменить устоявшийся в современной имплантологии принцип “Все так делают!” или “Нас так учили!”.
Кроме того, мы можем предсказывать степень атрофии и определять, потребуется ли наращивание костной ткани при отсроченной имплантации даже до того, как зубы удалены.
и, если потребуется, то каким методом это лучше сделать?
Или, например, мы можем объяснить, почему в одних случаях пересаженный костный блок уходит, а в других – нет?
Другие компоненты
Несмотря на свою прочность (как у бедра или нижней челюсти), в кости присутствуют органические вещества, которые дополняются неорганическими. Органическая составляющая представлена на 95% коллагеновыми белками, остальное количество занимают неколлагеновые, а также гликозминогликаны, протеогликаны.
Неорганическая составляющая костной ткани представляет собой кристаллы вещества, называемого гидроксиапатитом, содержащем в большом количестве ионы кальция, а также фосфора. Меньше в пластинчатой структуре кости содержится солей магния, калия, фторидов, бикарбонатов. Постоянно происходит обновление пластинчатой структуры, межклеточного вещества вокруг клетки.