Особенности проведения местной анестезии.
Для, так называемой «Групы Риска (ГР)» некоторые компоненты местной анестезии, могут оказаться особенно опасными.
Категории пациентов которые относятся к ГР:
- испытывающие повышенный страх (боязнь) перед лечением, врачами;
- с непереносимостью лекарственных препаратов;
- с некоторыми наследственными заболеваниями;
- женщины во время беременности (в крайних случаях, анестезия применяется, только во втором триместре);
- женщины во время лактации.
При применении местной анестезии перед врачом стоят несколько задач:
Во-первых, подбор местной анестезим, должен быть таким, чтоб полностью устранить чувствительность к боли в области вмешательства и получить максимум эффективности в ходе операции и после неё.
Во вторых, подобрать такой препарат, который сведёт к минимуму воздействие отдельных веществ находящихся в составе препарата.
Обратите внимание, на то, что если, после обезболивания, Вы всё равно чувствуете БОЛЬ, то скорее всего была недостаточная доза анестетика или анестезия была проведена неправильно!
Опытный стоматолог должен хорошо ориентироваться не только в действиях анестезирующих препаратов различных компаний, но и в их химическом составе.
Врач обязан знать:
- длительность действия местноанестезирующего препарата,
- время его выведения из организма,
- токсикологические свойства,
- применение анестетика с другими стоматологическими препаратами в разных сочетаниях и различных концентрациях.
Вопреки ожиданиям людей, современная медицина шагнула настолько далеко вперед, что делает любое лечение очень лёгким и комфортным даже для самых изнеженных пациентов.
Клиника «Империал» предлагает Вам ощутить новейшие разработки в анестезиологии и почувствовать комфорт вместо страха и боли.
Клиническая фармакология местных анестетиков
А.М.Овечкин*, С.А.Осипов** Московская медицинская академия им.И.М.Сеченова*, Российская медицинская академия последипломного образования**, Москва
Местные анестетики (МА) являются фармакологическим краеугольным камнем регионарной анестезии.
Химическая структура МА.
Молекула местного анестетика состоит из трех составляющих: липофильного ароматического бензольного кольца, гидрофильного третичного амина и соединяющей их цепочки. Химическая связь между этой цепочкой и ароматическим кольцом позволяет классифицировать МА на «эфирные» и «амидные». Амидные анестетики более стабильны и, в отличие от эфирных, практически не вызывают аллергических реакций.
Помимо основной молекулярной структуры некоторые амидные МА (бупивакаин и ропивакаин) различаются еще и как стереоизомеры, что определяет особенности их фармакодинамики. Стероизомеры имеют одинаковую химическую формулу, но различаются порядком расположения атомов вокруг основного атома углерода. Изомеры могут обозначаться как (+) и (-), или как R и S (право- и левовращающие. Обозначение (+) и (-) обозначает, в какую сторону молекула вращает поляризованный свет – вправо (+, R ), т.е. по часовой стрелке и влево (-, S ), против часовой стрелки. В частности, бупивакаин существует одновременно в S (-) и R (+) форме (рацемическая смесь), ропивакаин – в виде чистого S (-) изомера.
Клиническая фармакология МА.
В настоящее время МА эфирного ряда в нашей стране не применяются при нейроаксиальных блокадах, поэтому, обсуждая достоинства и недостатки современных МА, мы будем говорить преимущественно об амидных анестетиках. В клинической практике сегодня доступны анестетик средней продолжительности действия лидокаин (ксилокаин), а также МА длительного действия бупивакаин (маркаин) и ропивакаин (наропин).
Как известно, основными клиническими характеристиками МА являются:
- мощность
- скорость развития эффекта (латентный период)
- длительность действия
- токсичность
Физико-химические свойства МА ( которые, в свою очередь, зависят от химической структуры) во многом определяют их мощность, токсичность и клиническую эффективность.
Основные свойства местных анестетиков представлены в таблице 1.
Таблица 1.Физико-химические свойства местных анестетиков
.
Жирорастворимость МА
Мощность МА, в первую очередь, зависит от их способности растворяться в жирах, поскольку нейрональные мембраны представляют собой липопротеиновый матрикс, на 90% состоящий из липидов. МА с большей способностью растворяться в жирах являются более мощными. Липофильность анестетиков облегчает их проникновение через мембраны нейронов, что ускоряет связывание с протеинами внутриклеточной части натриевого канала.
Ионизация и константа диссоциации (рК)
МА являются слабыми основаниями (рК = 7,6-9,0). Значение рК (константа диссоциации) определяется рН, при котором половина молекул препарата находится в ионизированной, а половина в неионизированной (базисной) форме. Значение рК является постоянным для каждого МА. С войства ионизированной и базисной форм различны. Через клеточную мембрану проникают преимущественно неионизированные молекулы. Чем выше рК анестетика, тем меньшее количество его молекул находится в неионизированной форме.
МА с более высокой рК (бупивакаин, ропивакаин) характеризуются замедленным началом действия, за счет меньшего количества неионизированных молекул при рН организма. Значению рК бупивакаина (8,1) соответствует 20% доля базисной формы препарата при тканевом рН.
Способность МА связываться с белками
Одной из наиболее важных характеристик МА является длительность их действия. Она во многом зависит от способности связываться с белками (в основном, с кислым ?-гликопротеином (КАГП)). МА длительного действия, такие как бупивакаин и ропивакаин, имеют высокий потенциал связывания с белками. Эта особенность определяет их длительное связывание с протеинами нейрональных натриевых каналов, а значит и большую продолжительность действия. Пациенты с низким содержанием белков плазмы имеют повышенный риск проявлений системной токсичности МА. Плазменная концентрация КАГП увеличивается при различных патологических состояниях (операция, травма, тяжелое заболевание), что повышает степень связывания МА белками плазмы, т.е. играет защитную роль.
Способность связываться с белками плазмы влияет и на системную токсичность МА, которая обусловлена исключительно свободной, несвязанной фракцией препарата. Следует помнить, что при достижении «насыщения» плазменных белков молекулами МА их связывающая способность исчерпывается. При этом введение дополнительной дозы анестетика (или его абсорбция из эпидурального пространства) может быстро вызвать токсический эффект.
Системная абсорбция МА
Длительность нейрональной блокады, а также проявления системной токсичности в значительной степени зависят от скорости системной абсорбции МА из точки его введения. Степень васкуляризации того участка тела, в которое вводится препарат, влияет на скорость его абсорбции в системную циркуляцию, а также на пиковую плазменную концентрацию. Величина последней может быть представлена в следующем порядке: при внутриплевральной блокаде > межреберной блокаде > поясничной ЭА > блокаде плечевого сплетения из подмышечного доступа.
Факторами, влияющими на скорость абсорбции, являются степень ионизации препарата (рК), его жирорастворимость, способность связываться с белками плазмы, а также характер васкуляризации и перфузии окружающих тканей. Кроме того, на скорость абсорбции МА влияет степень их вазодилятирующего действия. Принято считать, что все МА, за исключением кокаина, являются вазодилятаторами. Особенно выражен данный эффект у лидокаина, что обусловливает целесообразность добавления адреналина для пролонгирования его действия. Не так давно было установлено, что ропивакаин обладает собственным вазоконстрикторным эффектом, поэтому длительность его действия не зависит от добавления вазоконстрикторов извне.
В поздние сроки беременности начальная пиковая плазменная концентрация МА может быть выше нормальной. Обусловленная гормональными изменениями повышенная проницаемость тканевых мембран для МА, снижение связывания МА белками плазмы, их повышенная кардиотоксичность на фоне увеличения синтеза прогестерона повышают риск системных токсических эффектов МА (особенно, бупивакаина).
Метаболизм МА
Амидные МА разрушаются в печени, с участием системы цитохромов Р450, от 1 до 5% препарата выделяется в неизмененном виде с мочой. Период полувыведения амидных МА значительно больше, чем эфирных. Клиренс амидных МА в значительной степени зависит от печеночного кровотока и активности энзимов. Он может быть нарушен на фоне сердечной недостаточности, печеночной недостаточности, приема b -блокаторов или блокаторов Н2-рецепторов.
Почечная недостаточность не оказывает существенного влияния на клиренс МА, поскольку процесс их инактивации происходит преимущественно в печени. Однако при этом возможна кумуляция метаболитов.
Дифференцированная блокада
Идеальный МА, используемый для послеоперационного обезболивания, должен селективно блокировать ноцицептивные волокна А? и С, не оказывая влияния на моторные волокна А? и А?. Установлено, что ропивакаин в низких концентрациях (0,2%) вызывает преимущественную блокаду А-дельта и С-волокон, при этом С-волокна он блокирует быстрее, чем А-волокна (Wildsmith J.,1997). Снижение концентрации анестетика (0,125%) увеличивает селективность сенсорной блокады. В более высоких концентрациях (0,5-0,75%) бупивакаин и ропивакаин проявляют сходное действие на моторные и сенсорные волокна. Способность ропивакаина вызывать дифференцированный сенсо-моторный блок является его клиническим преимуществом перед бупивакаином.
Дозирование МА. Приемлемо ли понятие «максимально рекомендуемой дозы»?
Вопрос выбора оптимальной дозы МА для того или иного метода регионарной анестезии до сих пор остается дискутабельным. Наиболее понятна ситуация со спинальной анестезией – у нас есть единственный анестетик спинальный маркаин 0,5% (простой и тяжелый), есть минимальная эффективная доза 10 мг и максимальная возможная 20 мг. В этих рамках мы и должны оперировать дозами, учитывая возраст пациента, его волемический статус, объем хирургического вмешательства и т.д.
Более или менее ясна ситуация с выбором дозы МА для блокады плечевого сплетения, поскольку известно, что ее эффективность определяется объемом введенного раствора МА (35-40 мл). Таким образом, общая доза зависит от концентрации избранного препарата (лидокаин 1-1,5%, бупивакаин 0,25%-0,5%, ропивакаин 0,75%).
Наибольшие сложности представляет выбор оптимальной дозы МА для ЭА. В настоящее время признаны абсолютно несостоятельными существовавшие в течение длительного времени рекомендации по дозированию МА при ЭА в миллилитрах на сегмент, миллиграммах на килограмм и т.п. Чем же руководствоваться, может быть максимальной дозой препарата, рекомендуемой его производителем?
Максимальная рекомендуемая доза МА (МРД), часто указываемая во вкладышах упаковок или текстах каталогов, широко используется в качестве простой количественной меры безопасного применения препарата, обычно выражаемой в мг/кг веса тела. В то же время, ни одна из рекомендуемых доз не обоснована с научной точки зрения. Основная цель всех существующих рекомендаций – избежать введения чрезмерной дозы анестетика, способной оказать системный токсический эффект. Однако при этом, как правило, не учитывается место введения препарата, а также факторы, влияющие на его метаболизм и экскрецию.
Большинство специалистов в настоящее время отказывается от концепции МРД, так как считает ее способной вводить в заблуждение в связи с:
- Существованием выраженных индивидуальных различий переносимости препарата.
- Возможностью возникновения тяжелой токсической реакции в случае непреднамеренной внутривенной инъекции дозы, значительно меньшей по сравнению с МРД.
- Концепция МРД может создавать иллюзию безопасности при использовании доз, не превышающих МРД, а также ложное представление о неизменной опасности более высоких доз.
В качестве примера приведем некоторые МРД местных анестетиков, представленные в фундаментальных зарубежных руководствах по анестезиологии.
Максимальные дозы МА у взрослых (Cousins M. & Bridenbaugh P. Neural Blockade in Clinical Anesthesia and Management of Pain, 3 th ed,1998, Miller R. Anesthesia, 5 th ed,2000)
| Препарат (торговое название) | Тип и год внедрения | Относитель-ная мощность | рК | Жирораство-римость | Связывание с белками |
| Прокаин (новокаин) | Эфирный, 1905 | 1 | 8,9 | 0,6 | 5,8 |
| Амидный, 1947 | 4 | 7,7 | 2,9 | 64,3 | |
| Бупивакаин (маркаин, анекаин) | Амидный, 1963 | 8 | 8,1 | 27,5 | 95,6 |
| Ропивакаин (наропин) | Амидный, 1996 | 7 | 8,1 | 14 | 94 |
| Местный анестетик | Простой | С адреналином | |||
| Лидокаин | 300 мг | 500 мг | |||
| Бупивакаин | 175 мг | 225 мг |
Интересно отметить, что в Европе МРД простого лидокаина на протяжении всего времени использования препарата не превышала 200 мг, в то время как в США она составляла 300 мг. Ряд сообщений о тяжелых осложнениях, связанных с применением бупивакаина (в том числе, с летальным исходом), послужил основанием для пересмотра его рекомендуемой дозы в сторону снижения.
Максимальные дозы бупивакаина и ропивакаина у взрослых (Pharmaca Fennica 2002, Finland,
RosenbergP.)
| Местный анестетик | Однократная доза | Суточная доза |
| Лидокаин | 150 мг (2 мг/кг) | 400 мг |
| Бупивакаин | 225 мг | 800 мг |
В связи с этим, сегодня правильнее говорить о диапазоне доз, приемлемых для среднего взрослого человека. Кроме того, доза должна быть скорректирована с учетом состояния (возраста) пациента, а также типа и объема планируемой операции. Во всех случаях необходимо стремиться к использованию наименьшей эффективной дозы.
Таким образом, концепция «максимальной рекомендуемой дозы» в настоящее время должна быть отвергнута, или, по крайней мере, пересмотрена.
Большинство авторов в последнее время избегает термина «максимально рекомендуемая доза» МА, приводя вместо этого эффективные дозы различных МА, применительно к той или иной методике РА.
Что касается ЭА, то, по нашему мнению, в реальной клинической ситуации выбор оптимального режима дозирования МА не представляет особых проблем. В современной анестезиологии ЭА чаще всего используется в качестве компонента: а) комбинированной спинально-эпидуральной анестезии, б) компонента общей анестезии (высокая ЭА при операциях на верхнем этаже брюшной полости, органах грудной клетки). В первом случае анестезия во время операции достигается, в основном, за счет спинального компонента и лишь иногда требуется эпидуральное введение болюсов МА (6-7 мл 0,5% бупивакаина или 0,75% ропивакаина). Во втором случае введение МА по ходу операции также осуществляется небольшими болюсами (8-10 мл 0,5% бупивакаина или 0,75-1% ропивакаина), в режиме «шаг за шагом», с ориентацией на этап операции, объем кровопотери, гемодинамические показатели и т.д. В тех редких случаях, когда ЭА является самостоятельным методом анестезии, ее индукция осуществляется в аналогичном режиме, посредством болюсного введения небольших доз МА через катетер, с мониторированием гемодинамики и скорости развития сенсорного блока. Одномоментная ЭА (без катетеизации эпидурального пространства) сегодня должна быть исключена из анестезиологического арсенала, так как СА является технически более простой, эффективной, безопасной и экономически оправданной ее альтернативой.
Аллергический потенциал МА
В большинстве случаев сообщения об аллергических реакциях, вызванных МА, представляют собой ложную интерпретацию различных клинических ситуаций, обусловленных действием этих препаратов. Чаще всего они исходят из стоматологической практики и при ближайшем рассмотрении оказываются следствием случайного внутрисосудистого введения МА (особенно адреналин-содержащих).
Истинные аллергические реакции на МА крайне редки и, в абсолютном большинстве случаев, связаны с применением эфирных МА. Чаще всего они обусловлены пара-аминобензойной кислотой, являющейся одним из продуктов деградации эфирных МА.
В литературе встречаются буквально единичные сообщения об аллергических осложнениях, вызванных амидными МА.
Токсичность МА
Токсичность МА проявляется в виде системных (воздействие на ЦНС и кардиотоксичность) и локальных токсических реакций (прямое нейротоксическое воздействие). Системная токсичность проявляется, в основном, при случайном внутрисосудистом введении МА и характеризуется возбуждением ЦНС, а также судорожной активностью.
Большие дозы МА повышают риск системной токсичности, в то же время, высокие концентрации анестетика и длительная экспозиция (в большей степени, чем общая доза) определяют прямой нейротоксический эффект.
Нейротоксичность МА
Гистологическими критериями нейротоксического действия МА являются повреждения шванновских клеток, а также аксональная дегенерация и вакуолизация мембран нейонов.
Лидокаин, в сравнении с бупивакаином (маркаином), обладает значительно более высоким прямым нейротоксическим эффектом. Крайней степенью проявления нейротоксичности является развитие транзиторного неврологического синдрома (ТНС). В абсолютном большинстве случаев развитие ТНС обусловлено использованием лидокаина (вне зависимости от дозы и концентрации) при СА и, в меньшей степени, при ЭА.
Системная токсичность МА (воздействие на ЦНС)
В зависимости от места введения, признаки системной токсичности могут появиться немедленно, или же через несколько часов после инъекции препарата. В экспериментальных исследованиях было показано, что чем выше скорость введения МА, тем ниже его доза, вызывающая судороги.
В клинических условиях судороги чаще всего возникают вследствие системной абсорбции при использовании больших доз МА для блокады периферических нервов и сплетений, а также при случайном внутривенном введение МА в дозах, предназначенных для регионарной анестезии. Последняя ситуация возможна при нераспознанном введении эпидурального катетера в позвоночную вену. СА с этой точки зрения представляется наиболее безопасной (максимальная доза – 20 мг спинального маркаина).
Проявления системной токсичности напрямую связаны с плазменной концентрацией МА. Введение МА в обильно васкуляризированные области (блокада межреберных нервов) ассоциируется с большим повышением плазменной концентрации анестетика, по сравнению с той же дозой препарата, использованной для блокады бедренного нерва.
Важно помнить о том, что системная токсичность лидокаина прогрессирует по мере увеличения дозы от признаков токсического воздействия на ЦНС до кардиотоксичности. В то же время, токсический эффект мощных МА (бупивакаин) может сразу проявиться тяжелой сердечно-сосудистой недостаточностью.
Кардиотоксичность МА
Кардиотоксический эффект МА определяется несколькими компонентами. В первую очередь, блокада Na -каналов нарушает нормальную атрио-вентрикулярную проводимость. Еще одним фактором, определяющим кардиотоксичность МА, является их угнетающее влияние на синтез АТФ в митохондриях.
В лабораторных условиях было установлено, что высокая кардиотоксичность бупивакаина связана с его крайне медленной диссоциацией из Na-каналов. В частности, период связывания бупивакаина с Na -каналами проводящей системы сердца в 1000 раз длительнее, чем у лидокаина. Блокада Na-каналов, обусловленная бупивакаином, очень стойкая, что существенно снижает эффективность реанимационных мероприятий при желудочковой фибрилляции (McClure J.1996). Позднее было установлено, что кардиотоксический эффект имеет выраженную стерео-специфичность (бупивакаин представляет собой рацемическую S- и R-вращающих изомеров), поскольку S-изомер обладает существенно меньшей токсичностью по сравнению с R-изомером.
После этого был создан и в 1996 г внедрен в клинику новый амидный анестетик ропивакаин, являющийся чистым S-изомером и представляющий собой аналог бупивакаина, в котором бутиловая группа заменена на пропиловую.
Сродство ропивакаина к Na-каналам промежуточно между лидокаином, который быстро связывается с открытым Na-каналом и быстро диссоциирует во время относительного рефрактерного периода, и бупивакаином.
Установлено, что индуцированная ропивакаином миокардиальная депресия и аритмия менее выражены, чем аналогичный эффект бупивакаина, при этом 10-кратное увеличение концентрации ропивакаина существенно не усиливает его кардиотоксическое действие (Carpenter R.,1997).
В экспериментальных условиях установлено, что ропивакаин подавляет синтез АТФ в митохондриях миокарда в меньшей степени, чем бупивакаин (Sztarc,1998). Аналогичные данные были получены и при сравнении влияния этих анестетиков на синтез АТФ в митохондриях клеток печени. Минимальное угнетающее влияние ропивакаина на синтез АТФ в митохондриях объясняет достаточную высокую эффективность реанимационных мероприятий при случайном внутрисосудистом введении токсической дозы этого анестетика.
Имеются cообщения о случайном внутривенном введении ропивакаина (до 150 мг) у 6 пациентов при попытке выполнения ЭА (Selander.,1997). Ни в одном случае не наблюдали кардиотоксического эффекта или других проявлений системной токсичности. Важно отметить, что аналогичная доза бупивакаина, введенная внутривенно, в 100% случаев привела бы к летальному исходу.
В целом, ропивакаин является » на 40% менее кардиотоксичным и » на 30% менее нейротоксичным, чем бупивакаин.
Способы профилактики токсического действия МА:
- Использование методик, снижающих вероятность внутривенного введения МА
- Обязательное выполнение аспирационных проб на всех этапах манипуляции
- Введение анестетика маленькими дозами с этапной оценкой наличия признаков системной токсичности
- Обязательное соблюдение максимальных рекомендуемых доз, особенно при блокаде периферических нервов и сплетений
- При необходимости введения значительных доз МА в обильно васкуляризированные области (блокада нервных сплетений) рекомендуется использовать препараты с низким кардиотоксическим эффектом (ропивакаин)
- Любая регионарная блокада должна выполняться в условиях, предусматривающих наличие препаратов и оборудования для сердечно-легочной реанимации
Лечение токсических проявлений действия МА.
Терапия токсических проявлений действия МА зависит от их интенсивности. Обычная последовательность лечебных действий такова:
- Обеспечение проходимости верхних дыхательных путей, ингаляция 100% кислорода (вспомогательная вентиляция в режиме гипервентиляции). Судорожный порог снижается на фоне метаболического ацидоза и увеличенного рСО2. Кроме того, ацидоз усиливает кардиотоксический эффект МА.
- При возникновении судорог мидазолам 0,05-0,1 мг/кг или тиопентал-натрия 1-1,5 мг/кг
- При неэффективности – сукцинилхолин 1-1,5 мг/кг и интубация трахеи
- При выраженной гипотензии – расширение объема инфузионной терапии + адреналин 0,02-0,2 мкг/кг/мин
- При остановке кровообращения — сердечно-легочная реанимация. У беременных со сроком > 24 недель показано экстренное кесарево сечение. Эта операция является жизне-спасающей, поскольку позволяет устранить компрессию нижней полой вены. Кроме того, маточно-плацентарный кровоток во время СЛР минимален, особенно при использовании больших доз адреналина.
ЛИТЕРАТУРА
- Butterworth J. Local anesthetics: pharmacology and clinical use. // Anesth. Analg.- 2002.-V.94 (3 Suppl S).- P.22-26.
- Carpenter R. Local anesthetic toxicity: the case for ropivacaine. // Am.J.Anesthesiol.- 1997.- V.24 (5, Suppl).- Р .4-7.
- McClure J. Ropivacaine. // Br.J.Anaesth. –1996. –V.76. – P.300-307.
- Rosenberg P. Maximum recommended doses of local anaesthetics – need for new recommendations? // Highlights in Regional Anaesthesia and Pain Therapy. XI. – Special Edition World Congress on Regional Anaesthesia and Pain Therapy – Barselona, Spain, 2002. – P.30-34.
- Selander D. Accidental IV injection of ropivacaine: clinical experiences of six cases. // Regional Anesth. – 1997. – V.22 (2S). – P.70.
- Thomas J., Schug S. Recent advances in the pharmacokinetics of local anaesthetics. // Clin.Pharmacokinet. – 1999.- V.36.- P.67-83.
- Wang R., Dangler L., Greengrass R. Update on ropivacaine. // Expert Opin. Pharmacother. – 2001.- V.2 (12).- P.2051-2063.
- Wildsmith J. Peripheral nerve block and ropivacaine. // Am. J.Anesthesiol.-1997.- V.24 (5; Suppl).- P.14-17.
Регионарная анестезия и лечение боли. Тематический сборник. Москва-Тверь 2004 г., стр.23-34
Составы компонентов препаратов современной местной анестезии
Составными компонентами местного анестетика (или местного обезболивающего), являются такие вещества как:
- Местный анестетик (артикаин, бупивакаин, лидокаин, мепивакаин, новокаин, прилокаин, тримекаин, этидокаин);
- Парагидроксибензоаты (пищевые добавки);
- Вещество для сужения кровеносных сосудов — Вазоконстриктор (адреналин или эпинефрин, мезатон, норадреналин или норэпинефрин, фелипрессин или октапрессин);
- Стабилизаторы (сульфит натрия, сульфит калия).
Препараты которые используются для местного наркоза, не всегда содержат все вышеперечисленные компоненты.
Для проведения блокады импульсов по нервным окончаниям, достаточно только одного, лишь местного анестетика, но для более продолжительного действия и усиления эффекта наркоза используют — вазоконстрикторы.
Практически все новые, местные, анестетические препараты, хот и в разной степени, но являются сосудорасширяющим средством, поэтому вазоконстрикторы являясь сосудосуживающим средством, помогают концентрировать анестетик, как раз в области стоматологического вмешательства.
Если у Вас есть противопоказания к таким веществам как адреналин, мезатон, норадреналин или фелипрессин, то местное обезболивающее, можно использовать и без сосудосуживающего средства, но при этом сокращается полезное время эффекта обезболивания.
Наличие в современных препаратах стабилизаторов и консервантов, говорит о том, что у этих анестетиков долгий срок хранения.
Противопоказания для использования местного наркоза
Все противопоказания к использованию местного обезболивающего средства можно объединить в 3 пункта:
- Гиперчувствительность иммунной системы организма на местный анестетик:
— При этом лечащий врач подбирает то обезболивающее, которое больше всего походит для планируемого стоматологического вмешательства (глубина, длительность, характер). - Недостаточность системы регуляции метаболизма пациента (очистка и выведение):
— Здесь учитываются особенности патологии организма пациента , его общесоматическое состояние, а также, наличие противопоказаний. - Ограничение по возрасту:
— В этом пункте принимаются во внимание дозировки местных обезболивающих препаратов, учитывая возраст пациента (ребёнок или пожилой человек) Критерии выбора местного обезболиваемого препарата (анестетика).
Общий наркоз
Общий наркоз – крайняя мера, когда прочие методы обезболивания оказались неэффективными. Когда применяется общий наркоз при лечении зубов:
- серьезные хирургические вмешательства (например, при остром или хроническом остеомиелите, множественном удалении зубов);
- если пациент страдает стоматофобией и нет другой возможности вылечить зубы, кроме как погрузиться в медикаментозный сон;
- если пациент (ребенок или взрослый) страдает ДЦП, аутизмом, синдромом Дауна, другими серьезными расстройствами психики;
- выраженный рвотный рефлекс или чрезвычайно обильное слюнотечение;
- аллергия на местную анестезию, невозможность подобрать подходящие препараты.
Противопоказания:
- серьезные заболевания сердца, высокое давление;
- тяжелые заболевания дыхательных путей.
Предварительно понадобится сдать общий анализ крови и ЭКГ, а также проконсультироваться у анестезиолога и стоматолога.
Виды препаратов для аппликационной анестезии
Аппликационная анестезия используется врачами клиники «Империал» для полного комфорта пациентов в виде мазей, растворов и аэрозолей. Использование данного средства позволяет сделать проникновение иглы полностью неощутимым.
Местные анестетики используемые в стоматологии «Империал»
| Название | Вид | Максимальная разовая доза |
| Дикаин / Тетракаин | 0,5-4% раствор или мазь | 20 мг |
| Анестезин / Бензокаин | 5-20% раствор, мазь, паста, присыпка | 5 г |
| Лидокаин | 5-15% аэрозоль, 2-5% мазь, гель | 200 мг (0,2 г.) |
| Пиромекаин / Бумекаин | 5% Мазь 2% раствор в ампулах | 400 мг (0,4 г.) |
Обезболивание нужного участка, при использовании аппликационной анестезии наступает через одну-две минуты, на глубину 1-3 мм и длиться от 10 до 20 мин.
Премедикация — подготовка к наркозу
Премедикацией — это использование одного или нескольких медикаментозных средств непосредственно перед операцией для облегчения анестезии и уменьшения риска возможных осложнений.
Самая распространенная премедикация, — седативная.
Седативные препараты, используемые для премедикации:
- Растительные препараты (настойка пустырника, валерианы, валокордин, корвалол, валосердин и др.)
- Транквилизаторы бензодиазепиновые (феназепам, диазепам, мидазолам и т.д.)
- Химические препараты (напр. триоксазин).
Показания к использованию седативной анестезии для премедикации
- Страх, ужас, перед стоматологическим лечением,
- нарушение кровоснабжения миокарда (ишемическая болезнь сердца),
- повышенное кровяное давление (гипертония),
- приступы удушья в следствии спазмов бронхов и отёка слизистой оболочки (бронхиальная астма),
- эндокринные заболевания (напр. сахарный диабет),
- интоксикация тиреоидными гормонами,
- болезнь Паркинсона,
- хронические неврологические стереотипные припадки (эпилепсия),
- наконец просто желание самого пациента.
Как повысить эффективность анестезии
Соблюдение нескольких очень простых правил значительно повысит эффективность анестезии и поможет сделать лечение зубов максимально безболезненным:
- При сильном волнении за 3-4 дня перед визитом к врачу можно попить мягкие успокоительные: персен, валерьянку, пустырник. Сильное беспокойство ухудшает качество анестезии, поскольку у людей в состоянии стресса нередко снижается болевой порог. В качестве альтернативы можно попросить сделать укол успокоительного прямо в стоматологической клинике – врачи обязательно пойдут навстречу.
- Как минимум за сутки перед посещением стоматолога стоит полностью отказаться от горячительного, так как алкоголь серьезно снижает эффективность анестезии.
- При скверном самочувствии, простуде или насморке стоит перенести визит. Стоит отложить визит к дантисту и женщинам в разгаре ярко выраженного ПМС либо в менструальный период.
Зубной анестетик врач подбирает индивидуально с учетом состояния здоровья и даже настроения каждого пациента. Поэтому так важно откровенно и подробно сообщить доктору о своих недугах и возможных опасениях.
Проведение общего обезболивания (общего наркоза) в стоматологии
Наркоз – является одним из способов обезболивания, основанным на блокировке сознания у пациента за счет глубокого торможения чувствительности, синапсов коры головного мозга, используя различные препараты.
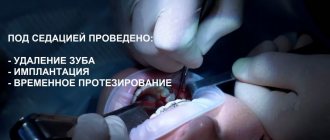
В связи с новыми разработками в анестезиологии наша стоматологическая клиника прекратила использования наркоза с вдыханием специализированного газа и начала использовать новый лицензированный метод, который называется СЕДАЦИЯ (введение в организм препаратов, которые вводят пациента в кратковременный управляемый медикаментозный сон). Стоимость нового седативного метода наркоза в течении 20-ти минут — 3700 рублей.
От того каким образом вводятся в организм лекарственные препараты, можно выделить несколько разновидностей седации:
- Ингаляционная седация
- Пероральная седация
- Внутривенная седация
В стоматологии чаше всего используется внутривенная поверхностная седация. Так, как при неглубокой седации, все функции организма продолжают свою нормальную деятельность, а человек находиться как бы во сне.
Седация это современный подход к лечению зубов во сне, покое. Видео
ЗАКС
Использование закиси азота (или веселящего газа) – старинный (применяется с 1844 г.) и весьма действенный способ обезболивания, который взяли на вооружение самые современные клиники. Вдыхание небольшого количества закиси азота в смеси с кислородом вызывает легкую эйфорию, оказывает расслабляющий и обезболивающий эффект (это называется седацией). Закись-азотно-кислородная седация абсолютно безвредна, действует практически мгновенно, выход из нее без всяких последствий занимает 10–15 мин.
Показания:
- страх и волнение перед лечением;
- юный возраст пациентов (чаще всего ЗАКС используется для малышей);
- длительное лечение (например, удаляют сразу много зубов);
- выраженный рвотный рефлекс, обильное слюноотделение.
Противопоказания:
- возраст младше 3 лет;
- выраженное опьянение, хронический алкоголизм;
- психические расстройства, тяжелые неврологические заболевания;
- чувствительность к отдельным компонентам смеси;
- очень сильное волнение перед предстоящими стоматологическими процедурами, гипервозбудимость или истерика (у детей);
- 1-й триместр беременности;
- крайне осторожно используют ЗАКС при повышенном давлении, перенесенном сотрясении мозга и других травмах головы;
- противопоказанием к седации могут стать серьезные инфекции дыхательных путей (астма, бронхит).
ЗАКС не исключает применения обычных анестетиков. Готовиться к ЗАКС каким-то специфическим образом не нужно, но за 2 часа до процедуры крайне желательно отказаться от любой пищи (пить можно). В день седации лучше взять выходной на работе и не садиться за руль. Детям в течение 1-2 ч после седации рекомендуется воздержаться от активных игр.