04.11.2019
Когда пациенту удаляют болящий зуб, он чувствует облегчение. Через несколько дней после операции ранка заживает, и все неприятности остаются позади. Но в период заживления травмированной десны следует особо внимательно наблюдать за ее состоянием. И если в лунке, которая образовалась после того, как человеку удалили зуб, появилось что-то белое, следует незамедлительно обратиться к стоматологу и выяснить причину такого явления.
Причины возникновения незаживающих ран
Непосредственная причина возникновения незаживающих ран – недостаточная активность восстановительных процессов в организме, замедленная регенерация тканей. При этом условия, при которых регенерация замедляется, могут быть разнообразными.
Среди общих факторов (т.е. затрагивающих состояние организма в целом) можно выделить следующие:
• ослабленный иммунитет по причине сопутствующего заболевания или хронического иммунодефицитного состояния;
• хроническая интоксикация организма;
• нарушение обмена веществ;
• сахарный диабет; это состояние можно рассматривать как тяжелую форму нарушения обмена веществ, а именно глюкозного обмена. Нарушения нормального усвоения глюкозы приводят к повышению хрупкости тканей и замедлению процесса регенерации;
• нарушение кровообращения – как общего, так и местного. Причиной могут стать атеросклероз, деформация сосудистых стенок, заболевания сердечно-сосудистой системы. Локальное нарушение кровообращения может быть вызвано продолжительным сдавливанием тканей и пережатием мелких кровеносных сосудов (пример хронической раны на фоне постоянного сдавливания тканей – пролежни);
• гипо- или авитаминоз по витаминам А, С, К и группы В, играющих важную роль в процессе регенерации тканей;
• недостаток в организме кальция или цинка;
• истощение – алиментарное (по причине недостаточного или неполноценного питания) или старческое;
• наличие онкологических заболеваний.
Специфический фактор появления хронических ран – нарушение кровообращения в ногах, чаще всего по причине варикозного расширения вен. На фоне нарушенного кровообращения на ногах (обычно в области голеней) развиваются трофические язвы – труднозаживающие дефекты тканей.
К местным факторам, затрагивающим непосредственно рану и область вокруг нее, относятся:
• инфекция;
• наличие в ране некротизированных тканей (они увеличивают риск нагноения и, соответственно, длительность заживления);
• наличие в ране инородных тел;
• наличие в ране излившейся крови (также повышает риск инфицирования);
• повторное повреждение незажившей раны.
Риск перехода раны в хроническую форму увеличивается, если, помимо кожи, повреждены и другие ткани – подкожная клетчатка, нервы, мышцы, сухожилия, кости.
Основные виды хронических ран
- Синдром диабетической стопы (СДС) – совокупность анатомо-функциональных изменений, развивающихся на фоне сахарного диабета, увеличивающих риск получения травмы и инфицирования мягких тканей стопы. По данным всемирной организации здравоохранения, риск развития СДС у диабетиков со «стажем» 5-10 лет составляет около 15%. У диабетиков со «стажем» более 15 лет он возрастает до 90%.
- Профилактика: защита ступней от травм, комплексный уход за ногами и ногтями, ношение обуви для диабетиков.
- Трофические язвы – осложнения при венозной недостаточности, вызванной изменениями из-за тромбофлебита или варикоза глубоких вен. Плохое кровообращение и кровоснабжение ног приводит к венозному застою, а он – к образованию плохо заживающих язв на лодыжках или голенях.
- Симптомы – отеки, нарушение пигментации кожи (покраснение или бледность), экзема, ощущение, что ноги распирает от давления (чаще к вечеру).
- Профилактика: своевременное лечение основного заболевания, ношения эластичных колготок, обработка кожи антисептическими и заживляющими средствами.
Симптомы незаживающих ран
•постоянная боль;
•несходящиеся края раны;
•постоянная кровоточивость;
•«застревание» раны на одном из этапов заживления более, чем на три недели;
•часто – неприятный запах;
•обычные средства лечения не помогают либо помогают слабо.
Эти признаки свидетельствуют о том, что процессы регенерации в тканях по тем или иным причинам нарушены. Для терапии хронических ран недостаточно местного лечения – необходимы комплексные меры.
Чтобы добиться прогресса в заживлении, необходимо обеспечить условия для восстановления нормального темпа регенерации. Они во многом зависят от причины появления хронической раны, однако существуют рекомендации, общие для всех ситуаций.
Организму необходимо обеспечить:
•сбалансированное питание – в частности, рацион следует обогатить витаминами А и группы В, стимулирующих регенерацию тканей, и витамином С, который способствует выработке коллагена – вещества, участвующего в формировании соединительной ткани, закрывающей рану на первых стадиях;
•нормальный режим сна – во сне процесс регенерации происходит активнее;
•защиту раны и области вокруг нее от внешних воздействий, таких, как натирание, сдавливание и т.п.;
•вентиляцию раны – без циркуляции воздуха рана быстро загноится.
Более частные рекомендации зависят от происхождения и характера раны.
Роль фибрина при воспалении
Выработка фибрина и воспаление – это два тесно связанных процесса. Белок играет важную роль при контакте с разрушающейся, поврежденной тканью. Освободившаяся из ткани тромбокиназа вступает в контакт с фибриногеном.
При свертывании крови все токсические вещества оказываются закупоренными в сгустке. Эта особенность воздействия белка при воспалительном процессе защищает организм от дальнейшего распространения токсинов и их негативного воздействия. Подобная реакция получила название фиксации. Таким образом, фибрин – это еще и защитник организма от токсинов.
Лечение незаживающих ран с учетом их причины возникновения
Приступая к лечению повреждений подобного рода, необходимо понять причину их появления. От этого будут зависеть дальнейшие действия.
1.Прежде всего, необходимо обследовать рану на предмет инородных тел, некротизированных тканей, излившейся крови и при необходимости произвести очистку. Обратите внимание, что инородные тела настоятельно не рекомендуется удалять самостоятельно! Подобные попытки могут привести к дополнительным повреждениям тканей и увеличить риск инфицирования. Необходимо обратиться за помощью к врачу.
2.При нарушении местного кровообращения необходимо устранить источник давления на ткани (изменить положение тела пациента с пролежнями, носить более свободную одежду/обувь при «диабетических» ранах).
3.При лечении трофических язв на ногах необходимо воспользоваться компрессионными чулками или бандажами – они помогут «поддержать» сосуды и нормализовать кровообращение, а также «подтянуть» друг к другу края раны для более быстрого заживления.
4.При истощении и авитаминозах требуется обеспечить нормальное сбалансированное питание, чтобы обеспечить организм необходимыми веществами для регенерации тканей и выработки коллагена – вещества, активно участвующего в ранних стадиях процесса заживления и помогающего стягиванию краев раны.
5.При сахарном диабете (любого вида) необходимо следить за уровнем глюкозы в крови.
После создания оптимальных условий для заживания раны можно приступать к ее обработке и лечению.
Естественные причины появления белого налета на ране, образовавшейся после удаления зуба
После удаления зуба в ротовой полости остается открытая рана, через которую, не будь у человека иммунитета, проникали бы любые болезнетворные микроорганизмы. Но такие защитные реакции организма существуют, и они запускаются сразу после изъятия корня из лунки.
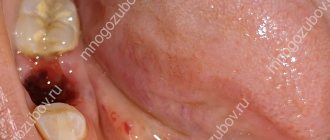
В крови человека содержатся вещества, которые при нарушении стенок сосудов образуют тромб из фибрина, препятствующий открытию кровотечения. В ротовой полости этому процессу способствуют и особые компоненты слюны. Часть фибрина оседает на поверхности раны. У некоторых людей этот слой практически не заметен, у других образуется видимый фибринозный налет белого цвета, как на месте вырванного зуба на фото справа.
Если регенерация тканей проходит без осложнений, фиброзный налет со временем исчезает. Образовавшаяся внутри лунки пустота заполняется эпителием и соединительной тканью, после чего на этом месте образуется костная ткань. Процесс заживления костной ткани после удаления зуба показан на фото:
Через несколько суток после экстракции десна около лунки становится более бледной. Это означает, что воспалительный процесс, который всегда развивается после операции как естественная защитная реакция организма, стихает. Прилив крови к ране уменьшается, и цвет слизистой оболочки десны становится прежним.
Принципы (стадии) лечения
Действия при лечении раны зависят не только от условий и причин ее появления, но и от стадии, на которой в ней остановился раневой процесс.
Первая стадия раневого процесса – острая. Во время нее происходят сосудистые изменения, вызванные реакцией на повреждение, и активно идет процесс сворачивания крови. Если рана инфицирована, идет образование гноя и одновременное всасывание в ткани токсических веществ.
На этой стадии необходимо, прежде всего, очистить рану – удалить из нее отмершие ткани, извлечь (с помощью врача) инородные тела, провести дренирование – отвести из раны гной и экссудат. Также необходимо предотвратить попадание в рану инфекции. Лучше всего промывать поврежденную область физиологическим раствором, так как едкие дезинфицирующие жидкости могут нанести вред окружающим здоровым тканям.
Вторая стадия раневого процесса – грануляция. На этой стадии поверх раны начинает образовываться тонкий слой соединительной ткани. Края раны начинают стягиваться, а она сама закрываться. В слое соединительной ткани формируются тончайшие капилляры, обеспечивающие питание регенерирующим тканям. Нередко хронические раны останавливаются на этой фазе, и дальше процесс заживления не идет; чаще всего именно так происходит с трофическими язвами.
На стадии грануляции важно, во-первых, защитить новообразованную ткань от механических повреждений, во-вторых, стимулировать дальнейшую регенерацию, и в-третьих не допустить развития воспалительного процесса – несмотря на то, что рана закрыта, риск инфицирования и воспаления сохраняется. Для стимулирования регенерации тканей используется метилурациловая мазь (можно использовать готовую повязку Воскопран с метилурациловой мазью) для защиты поверхности раны следует использовать атравматические повязки, которые не прилипают к раневой поверхности и не травмируют её.
Не следует забывать и о соблюдении поддерживающей диеты, а также режима сна – это поможет ускорить процесс заживления.
Раневой процесс представляет собой сложный комплекс реакций, развивающихся в организме в ответ на повреждение тканей. С точки зрения общей патологии, заживление любой раны есть воспаление, которое последовательно проходит стадии альтерации (повреждения), экссудации (выхода жидкой части крови и клеток воспаления за пределы сосудистого русла) и пролиферации (восстановления утраченных тканей путем образования рубца) [8]. Однако клинически удобным оказалось разделить фазы заживления несколько иначе. В отечественной литературе более принятой является классификация отделения ран и раневой инфекции Института хирургии им. А.В. Вишневского, разделяющая течение раневого процесса на три основные фазы.
I — фаза воспаления;
включает
сосудистые реакции
(вазоконстрикцию, сменяющуюся вазодилатацией),
экссудацию
с выходом плазменных белков, миграцию и выход форменных элементов крови в зону повреждения, выпадение фибрина с отграничением зоны повреждения, отек и инфильтрацию окружающих тканей. В последующем фибрин подвергается фибринолизу и происходит
очищение
раны от некротизированных тканей и микроорганизмов с участием лейкоцитов и их ферментов. Начинается сразу после ранения и в отсутствие осложнений продолжается в среднем 4-5 сут.
Некоторые исследователи предлагают выделять в первой стадии раневого процесса фазы альтерации,
включающей первичную деструкцию и сопутствующие биохимические изменения, и
экссудации и вторичной деструкции,
в ходе которой происходит отторжение погибших тканей и очищение раны.
II — фаза регенерации (репарации),
или
образования и созревания грануляционной ткани,
характеризуется миграцией фибробластов, образованием ими коллагена и основного вещества, новообразованием сосудов и развитием грануляционной ткани в месте тканевого дефекта. Постепенно происходит уменьшение экссудации и отека, грануляционная ткань заполняет весь дефект. Эта фаза начинается с 1-х суток после ранения и продолжается в среднем 2-4 нед. Ее продолжительность зависит от величины раневого дефекта и морфологического строения поврежденных тканей.
III — фаза образования, реорганизации рубца и эпителизации,
она не может быть четко отделена по времени от II фазы. Эпителизация начинается от краев раны одновременно с образованием грануляционной ткани. Сразу после образования рубца начинается его перестройка: происходит образование эластических волокон и новой фиброзной сети, а содержание воды в рубцовой ткани снижается. Процесс эпителизации регулируется действием эпидермального хейлона, являющегося контактным ингибитором пролиферации. Важнейшим условием нормального заживления раны является, с одной стороны, строгая синхронизация процесса эпителизации, с другой — созревание грануляционной ткани. Равновесие между созреванием и рассасыванием грануляций и рубцовой ткани лежит в основе феномена раневой контракции — равномерного концентрического сокращения краев и стенок раны.
Во II и III фазах заживления раневая контракция, как правило, сочетается с интенсивной эпителизацией, что свидетельствует о нормальном течении раневого процесса. В зависимости от морфологического строения тканей процесс продолжается от нескольких месяцев до года [3, 22, 24].
Приведенная классификация довольно точно отражает основные этапы течения раневого процесса и позволяет определить патогенетически направленное лечение соответственно фазе заживления раны.
Примерно так же различают этапы заживления зарубежные авторы:
— Inflammatory phase (стадия воспаления);
— Proliferative (also called «Reconstruction») (стадия репарации);
— Maturation and remodeling phase (стадия ремоделирования) [24].
С учетом современных взглядов нельзя обойти вниманием активное участие на ранних стадиях раневого процесса неконтролируемого образования в клетках свободных радикалов в результате «респираторного взрыва» в полиморфно-ядерных лейкоцитах. В упомянутых клетках образуются мощные биооксиданты — активные формы кислорода (АФК), обладающие выраженной цитотоксической активностью по отношению к бактериям и эукариотам [25]. При этом АФК являются инициатором свободнорадикальных реакций (СРР) перекисного окисления липидов (ПОЛ), которым в настоящее время отводится роль фундаментальной молекулярной основы различных патологических процессов. Помимо активации фагоцитов, среди механизмов, обеспечивающих увеличение продукции АФК, способных запускать СРР, следует выделить следующие:
— нарушение транспорта в дыхательной цепи митохондрий;
— интенсификацию синтеза и окисления катехоламинов;
— активацию системы ксантин-ксантиноксидаза [23].
Основным субстратом СРР являются ненасыщенные жирные кислоты, входящие в состав фосфолипидов клеточных мембран, мембран субклеточных органелл и липопротеидов плазмы крови. Показано, что в физиологических условиях продукты СРР участвуют в регуляции проницаемости биомембран и скорости пролиферации клеток. В случае избыточного накопления гидроперекисей жирных кислот наблюдаются ингибиция синтеза белка, блокада функций макрофагов (хемотаксическая и ферментная активность), дезинтеграция клеточных мембран, инактивация тиоловых ферментов и др. Свободные радикалы могут изменять конформацию белков, увеличивать чувствительность субстратов к протеолизу, повреждать молекулу ДНК вплоть до ее фрагментации [6].
Являясь частью общего адаптационного синдрома, регуляция СРР ПОЛ в ране осуществляется путем включения нескольких параллельно действующих механизмов. Несмотря на значительное многообразие, их можно сгруппировать в два типа: инициации образования свободных радикалов и элиминации (перехвата) продуктов ПОЛ. В норме процессы инициации и элиминации контролируются действием сбалансированной эндогенной системы гидрофильных и гидрофобных перехватчиков свободных радикалов (антиоксидантов). Однако при травме наблюдается гиперпродукция свободных радикалов (особенно в ранний период воспаления) при одновременном снижении активности эндогенных антиоксидантов, что сдвигает равновесие в сторону ускорения СРР ПОЛ. Сущность проявления деградирующего действия АФК в условиях их гиперпродукции в ране заключается в образовании обладающих высокой реакционной способностью гидроксильных радикалов ОН-, которые в условиях уменьшения активности системы антиоксидантной защиты запускают вторичные СРР пероксидации липидов мембран клеток не только в зоне раневого дефекта, но и в клетках перифокальной зоны. В результате наблюдается задержка развития последующих за воспалением фаз раневого процесса. Безусловно, такое развитие событий свидетельствует о срыве общего адаптационного синдрома и может расцениваться как признак неблагоприятного течения раневого процесса. Введение в раневой дефект некоторых веществ обусловливает продуцирование АФК. Так, использование Cu-аскорбатной смеси, ксенобиотиков, зимозана вызывало индуцирование процесса выработки гидроксильных радикалов в тканях раневого дефекта. Увеличение содержания АФК всегда приводило к задержке заживления ран, определяемой морфологически. Следует отметить, что процессы активации и элиминации продуктов ПОЛ неоднократно сменяют друг друга на различных стадиях раневого процесса. Активация ПОЛ преобладает на этапах воспаления и образования грануляций, ингибиция — в период очищения раны и эпителизации. Период реорганизации рубца характеризуется равновесием про- и антиоксидантных систем. Данный факт демонстрирует циклический характер течения раневого процесса и дает основания рассматривать заживление с точки зрения биоритмологии.
На течение раневого процесса влияют различные общие и местные факторы. Ухудшают течение раневого процесса наличие полирезистентной ассоциативной микрофлоры, высокая степень микробной контаминации, наличие инородных тел, нарушение оттока раневого отделяемого. Замедляют течение раневого процесса ухудшение регионарного артериального и венозного кровообращения, анемия, недостаточное питание и снижение иммунитета, наличие таких сопутствующих заболеваний, как сахарный диабет и коллагенозы, а также прием глюкокортикоидов и цитостатиков [3].
В современной клинической хирургии общепризнанным считается положение, что любая случайная рана является бактериально загрязненной, или первично инфицированной. Под термином «бактериально загрязненная рана» следует понимать такое состояние раны, при котором общие и локальные механизмы защиты способны подавить попавшие в рану микроорганизмы и не наблюдается никаких клинических признаков инфекционного процесса в ране. Следовательно, само по себе присутствие микроорганизмов в ране (даже патогенных, не говоря уже о группе условно-патогенных) еще не делает развитие инфекции в ране обязательным. По современным представлениям, лизис некротизированных тканей в I фазе раневого процесса происходит не только под действием ферментов раневого экссудата. В этом сложном процессе определяющую роль играет микрофлора. Установлено, что в начальный период воспалительной реакции микроорганизмы инициируют миграцию лейкоцитов к очагу инфекции, а в более поздние сроки путем ферментативного расщепления некротизированного субстрата выводят из раны все, что не было убрано механическим путем. Таким образом, представляется, что с биологической точки зрения присутствие микроорганизмов в ране является целесообразным. По этой причине И.В. Давыдовский [17] полагал, что микрофлора, будучи пассивным «продуктом раны», не вредна и борьба с ней, осуществляемая со времен Листера, лишена всякого смысла. Вплоть до конца XIX века, когда были предложены антисептический и асептический методы ведения раны, заживление через нагноение воспринималось как нормальное. Кроме того, микробная контаминация раны не всегда сопровождается классическими симптомами раневой инфекции. Так, например, большое количество бактерий присутствует на поверхности часто не имеющих признаков воспаления хронических ран, таких как трофические язвы или пролежни. Однако подобная не проявляющая себя воспалением колонизация при неадекватном лечении или при отсутствии такового может быстро развиваться в угрожающую жизни септицемию.
Инфекция в ране развивается при нарушении равновесия между микроорганизмами, загрязняющими рану, и защитными силами макроорганизма, что проявляется клиническими симптомами воспаления. Значение бактериального обсеменения ран для пострадавшего определяется множеством факторов: абсолютным и относительным количеством микробных тел, их патогенностью, способностью защитных сил организма бороться с возможной инфекцией. С клинической точки зрения, ведущим фактором, определяющим возможность перехода бактериально загрязненной раны в инфицированную, является функциональное состояние поврежденных тканей. Развитие инфекции наиболее вероятно в обширных бактериально загрязненных ранах, содержащих большое количество нежизнеспособных или поврежденных тканей, служащих отличной питательной средой для бактерий. Для сравнительной оценки способности различных микроорганизмов вызывать инфекционный процесс разработан ряд качественных показателей, характеризующих степень их агрессии. К ним относят: патогенность, вирулентность и токсичность.
Для реализации инфекционного процесса в ране микроорганизмы должны обладать определенными количественными (число попавших в рану возбудителей) и качественными (факторы инвазивности) характеристиками, которые находятся в обратной зависимости.
Для гнойных ран различного генеза характерно, что в них среди представителей раневой микрофлоры на всех этапах обследования больных, по данным разных авторов, преобладают стафилококки, которые выделяются как в монокультуре, так и в различных ассоциациях. По данным большинства источников литературы, наблюдается довольно высокий процент выделения грамотрицательных микроорганизмов, особенно синегнойной палочки, частота обнаружения которой значительно возрастает во время пребывания больных в стационаре [4, 7]. За последние годы под влиянием различных факторов, в первую очередь мощного селективного действия антибиотиков, произошли значительные изменения этиологии раневых инфекций. Отчетливо прослеживается зависимость микрофлоры ран от их происхождения. Так, например, если при острых гнойных заболеваниях стафилококк в монокультуре выявляется в 69,5% случаев, то при посттравматических гнойных ранах, хронических гнойных заболеваниях кожи и мягких тканей, а также при гнойных ранах и развившемся сепсисе высевается сразу несколько патогенных микроорганизмов в 31,5, 48,8, 55,6% случаев соответственно. Остальную часть составляют представители семейства Enterobacteriaceae
в монокультуре. Многолетние исследования качественного состава микрофлоры разных ран свидетельствуют об устойчивом преобладании стафилококков
(S.aureus, S. epidermidis)
и неферментирующих грамотрицательных бактерий. В то же время в случае генерализации инфекционного процесса у больных, длительно находящихся в стационаре, видовой состав микрофлоры, выделяемой из ран, значительно шире по сравнению с микроорганизмами, выделяемыми из гемокультур. В последние годы значительно чаще из ран стали выделяться грибы (9,9%), что, по-видимому, связано с недостаточным вниманием к этой проблеме, отсутствием надежной профилактики. Существенную роль в этиологии раневой инфекции играют также облигатные неспорообразующие анаэробные микроорганизмы, среди которых чаще всего встречаются
Bacteroides
spp.,
Fusobacterium, Peptococcus
spp.,
Peptostreptococcus
spp.,
F. nucleatum, P. melaninogenicus.
Удельный вес чистой неклостридиальной и смешанной аэробно-анаэробной микрофлоры также зависит от локализации и происхождения гнойной раны [4].
С развитием нагноения даже исходно нормальный раневой процесс вначале замедляется и останавливается, затем начинает развиваться в нежелательном направлении [3]. Бактериально загрязненные раны становятся инфицированными, а затем гнойными с изменением цвета, запаха и резким увеличением продукции экссудата. Известно, что пороговое количество возбудителей, при котором рана становится инфицированной, составляет 105 на 1 г ткани. Однако многочисленные исследования этого показателя в различных ранах свидетельствуют о том, что количественный микробный пейзаж раневой поверхности может меняться практически ежедневно. В основе тормозящегося, останавливающегося, а нередко и поворачивающегося вспять процесса заживления раны лежит деятельность бактериальных ферментов (токсинов). Воспаление в ответ на микробную агрессию может возникнуть на любой стадии заживления, возвращая раневой процесс вновь к I его стадии [3].
Современные методы лечения гнойных ран
Основным методом лечения, позволяющим быстро очистить рану от некротизированных тканей, полноценно дренировать и создать условия для заживления, является хирургическая обработка раны, промывание ее растворами антисептиков (по возможности пульсирующей струей), дренирование раны и раннее ее закрытие оперативным путем [13]. В отечественной литературе до настоящего времени объем хирургической обработки трактуется по-разному. Чаще после достаточного рассечения в зоне гнойного очага со вскрытием всех гнойных затеков под визуальным контролем хирурги иссекают лишь явно некротизированные ткани с последующим дренированием раны различными способами [20]. Другие хирурги стоят на позициях более радикального (максимального) удаления всего гнойно-некротического секвестра [14]. Однако на практике эти принципы хирургического лечения гнойной раны выполняются далеко не всегда. Так, М.И. Кузин и соавт. [21] считают, что полная хирургическая обработка раны возможна у 70-80% больных и лишь в 35% наблюдений после нее можно наложить первичные швы. Невозможность и нецелесообразность оперативного закрытия раны определяют необходимость проведения ее местного лечения. Подчеркнем, что хирургическое лечение, местная и медикаментозная терапия гнойной раны являются конкурирующими или взаимозаменяющими методами. Их можно рассматривать только в качестве дополняющих друг друга компонентов комплексного лечения гнойной раны.
Помимо хирургического очищения раны, в современной литературе выделяют еще четыре способа: аутолитический, физический (механический), ферментативный и так называемый биохирургический. Выбор способа зависит от многих факторов, таких как размер, локализация, тип раны, необходимая эффективность и селективность некрэктомии, уровень болевых ощущений, количество экссудата, риск инфекции и стоимость лечения. В большинстве наблюдений имеет смысл последовательное или сочетанное применение сразу нескольких способов очищения раны.
Аутолитическое очищение
в той или иной степени отмечается во всех ранах. Оно является естественным и высокоселективным процессом, который осуществляют эндогенные протеазы, расщепляющие некротизированные ткани. Основными источниками протеаз служат нейтрофилы, продуцирующие эластазу, коллагеназу, миелопероксидазу, гиалуроновую кислоту и лизосомальные ферменты.
Аутолитическое очищение может не обеспечить быстрое очищение и заживление раны, но использование окклюзионных повязок позволяет значительно ускорить этот процесс путем поддержания влажной среды и обеспечения оттока экссудата. Это способствует безболезненному очищению от мертвых тканей и формированию здоровых грануляций. Аутолизис может привести к образованию значительных количеств экссудата. Обычно аутолитическое очищение достигается при использовании окклюзионных повязок с целью создания влажной среды в ране. Рост антибиотикорезистентности микроорганизмов возродил определенный интерес к применению меда для лечения ран и трофических язв. Антимикробный эффект меда обеспечивает быстрое аутолитическое очищение и дезодорирование ран, вдобавок он имеет противовоспалительные свойства и стимулирует иммунный ответ. Несмотря на то что точный механизм действия неясен, A. Tonks и соавт. [30] выявили значительное снижение активности продуктов свободнорадикального окисления (р<0,001), также была существенно повышена продукция TNFα (p<0,001) при аппликациях разных видов меда. С практической точки зрения аутолитическое очищение ран является наиболее простым методом, однако обычно оно требует слишком много времени для полного очищения от некротизированных тканей.
Физическое (механическое) очищение
раны является неселективным методом удаления некротизированных тканей и детрита путем использования механической силы. Метод легко выполним и дает более быстрый эффект, чем аутолитическая или ферментативная некрэктомия. Однако неселективность метода может привести к значительному повреждению здоровых грануляций, часто создает значительный дискомфорт для пациента из-за болевых ощущений. Несмотря на эти недостатки, применяется несколько видов механического очищения ран. Влажно-высыхающие повязки являются простейшим способом механического очищения. Влажная марлевая повязка помещается на раневое ложе и постепенно высыхает, поглощая некротизированные ткани и детрит. Вместе со сменяемой повязкой механически удаляются из раны и впитавшиеся в нее некротизированные ткани [26, 27].
На сегодняшний день в лечении гнойных ран применяется огромный арсенал технических средств, оказывающих то или иное физическое
воздействие на рану. Это обработка ран пульсирующей струей. Обработка раны струей воды или антисептика под высоким или низким давлением приводит к вымыванию из раны бактерий, инородных тел и некротизированных тканей. Однако, если давление слишком велико, есть риск более глубокого проникновения бактерий и детрита в рану или повреждения жизнеспособных тканей. Использование пульсирующей струи может быть очень эффективным для размягчения и удаления из раны детрита, экссудата, бактерий. Убедительно доказан положительный эффект при использовании СO2-лазера. В лечении гнойных ран хорошо зарекомендовала себя методика применения ультразвука низкой и средней частоты. Благодаря тому, что ультразвук по-разному распространяется в живых и нежизнеспособных тканях и отражается на границе их раздела, он ускоряет процессы отторжения некротизированных тканей. Вместе с тем многие авторы указывают на повреждающее действие ультразвука на здоровые ткани [13]. Вакуумирование ран — это неинвазивный способ механического очищения путем создания отрицательного давления в герметичной системе над раневым ложем. Он применяется при лечении хронических ран и позволяет уменьшить количество экссудата и отторгающихся некротизированных масс, снизить отечность тканей, повысить скорость периферического кровотока, улучшить оксигенацию тканей, стимулировать ангиогенез и рост грануляций [16]. В последние годы активно изучается физическая и биостимулирующая активность в отношении ран NO-содержащего плазмодинамического газового потока.
Ферментативное очищение ран
— это высокоселективный метод, при котором используются природные протеолитические энзимы, производимые фармацевтической индустрией специально для лечения ран [9-11]. Вносимые протеазы действуют в ране совместно с эндогенными ферментами организма [15]. В основном ферментные препараты производятся на основе бактериальной коллагеназы, папаина/мочевины, трипсина, фибринолизина/ДНКазы, комбинации стрептокиназы — стрептодорназы и субтилизина. Только первые три продукта широко представлены на рынке. В разных странах традиционно применяется один или два из указанных препаратов, в зависимости от доступности сырья. Ферментные препараты применяются в сочетании с другими биологически активными препаратами [5].
Биохирургия.
Использование личинок мух для очищения и заживления ран известно с момента опубликования первых работ в 1931 г. Этот метод требует применения стерильных личинок, которые переваривают отторгающиеся некротизированные массы из раны без повреждения окружающих нормальных тканей. В исследовании K. Mumcuoglu и соавт. [29] полное очищение ран личинками было достигнуто у 38 (88%) из 43 пациентов с хроническими венозными язвами и пролежнями. В 5 из этих наблюдений первоначально планировалась ампутация конечности по поводу язв. Sherman, наблюдая группу из 103 пациентов с пролежнями, отметил, что при применении личинок полного очищения ран удалось добиться в 80% наблюдений по сравнению с 48% при использовании влажно-высыхающих повязок. Точный механизм очищения и заживления ран с помощью личинок до конца неясен. Существуют предположения, что они способны поглощать и убивать бактерии, давать бактериостатический эффект, повышая рН раны, выделять протеолитические ферменты и повышать обеспечение тканей кислородом. Тем не менее, несмотря на упомянутые выше оптимистичные данные, некоторые пациенты отмечают болевые ощущения во время лечения личинками. Также нельзя не принимать во внимание эстетические и психологические аспекты применения личинок мух.
Наряду с местными методами лечения гнойной раны нельзя недооценивать и средства общей медикаментозной терапии. Это в первую очередь антибактериальные препараты [4]. Широкое применение антибиотиков, эффективность которых первые десятилетия после изобретения не ставилась под сомнение, уже к 70-м годам прошлого века стало причиной ряда проблем. Мутагенное воздействие антибиотиков на микроорганизмы привело к изменению этиологической и биологической сущности гнойных процессов. Как показывают многочисленные исследования, изменилась структура возбудителей гнойных осложнений ран [4, 7]. Наряду с традиционными грамположительными и грамотрицательными аэробными микроорганизмами значительная доля приходится на анаэробные микроорганизмы, грибы. Ассоциация аэробов и анаэробов в гнойных посттравматических ранах, пролежнях, у больных с «диабетической стопой» встречается в 98,8% случаев. От 80 до 100% выделяемых штаммов нечувствительны к пенициллину, цефалотину, цефазолину, тетрациклину, канамицину, гентамицину. Необходимо подчеркнуть, что речь идет о системном применении антибиотиков. Местное применение антибиотиков обычно не приветствуется (особенно зарубежными авторами), поскольку может приводить к возникновению аллергических реакций или появлению антибиотикорезистентных штаммов бактерий. Непосредственно вводить в рану целесообразно лишь некоторые специально разработанные антибиотики: полимиксин М, неомицин, грамицидин [21, 28].
В настоящее время на фоне переоценки места антибиотиков возродился интерес к антисептикам. Последние представляют химические вещества (независимо от источника получения и состава), которые обладают противомикробным свойством и используются для нанесения на поврежденную и неповрежденную кожу, слизистые оболочки, полости и раны в целях лечения и предупреждения развития местных инфекционных поражений и сепсиса. Утверждается, что при ранах легкой и средней тяжести можно ограничиться локальным применением антисептиков и антибиотиков. Лишь при осложнении раневого процесса развитием приобретенного иммунодефицита местное применение антисептиков следует сочетать с парентеральным введением антибиотиков, не обладающих перекрестной устойчивостью с внесенными локально антисептиками. Среди антисептиков наиболее часто используют растворы: перекиси водорода (3%), перманганата калия (0,1-0,5%), борной кислоты (1-3%), диоксидина (1%), хлоргексидина (0,02%). Водные растворы перекиси водорода и перманганата калия, традиционно применяемые для обработки гнойных ран, существенно не влияют на микробную флору, их антисептический эффект ограничивается раневой поверхностью и не распространяется вглубь тканей, где гнездятся микроорганизмы. Использование раствора перекиси водорода отвечает скорее требованию щадящей механической обработки, чем обеззараживания [27]. В настоящее время известно большое количество антисептических препаратов, обладающих неплохими бактерицидными свойствами [4]. Однако в составе большинства из них имеются различные раздражающие вещества, такие как ртуть, йод, поливинилпирролидон, вызывающие аллергическую реакцию у ряда больных, что ограничивает их применение. Из современных средств заслуживает внимания препарат лавасепт (водный раствор бигуанида полигексанида), проявляющий высокую активность в отношении бактерий и грибов, включая стафилококки, энтерококки, синегнойную и кишечную палочки, не угнетающий формирование грануляционной ткани в ране. Используемые в настоящее время антисептики в основном обладают ограниченным спектром действия. Но врач не всегда может своевременно установить вид возбудителя и его спектр чувствительности, а в последнее время гнойные процессы вызываются ассоциированными микроорганизмами. Процесс формирования резистентности микроорганизмов в равной степени распространяется не только на группу антибиотиков, но и на традиционные антисептики. Так, например, растворы фурацилина, риванола, борной кислоты (3%) практически полностью утратили антимикробную активность по отношению к основным возбудителям хирургической инфекции. Чувствительность госпитальных штаммов S. aureus, E. coli, B. coli
к антисептикам, мазям на жировой основе не превышает 1-5% [4].
По меньшей мере 25% всех больных, у которых имеются раны, нуждаются только в исходном лечении повязками [12].
Повязка — одно или несколько перевязочных средств, наложенных на поврежденную или интактную кожу человека с целью создания условий для его выздоровления. В этом определении подчеркнуто лечебное воздействие повязки на весь организм, а не только на рану.
Требования к повязкам на разных стадиях раневого процесса
Важно подчеркнуть, что требования к повязкам отчетливо изменяются на разных этапах раневого процесса. Так, например, свежие раны до момента полного покрытия их грануляциями способны всасывать токсины, бактерии, продукты распада тканей. Раны, покрытые грануляциями, практически не обладают всасывающей способностью. В связи с этим в I фазе раневого процесса все лечебные препараты должны обладать высокой осмотической активностью, чтобы обеспечить интенсивный отток экссудата из глубины раны в повязку, антибактериальное воздействие на возбудителей инфекции, отторжение и расплавление некротизированных тканей, эвакуацию раневого содержимого. Таким образом, роль повязки в I фазу раневого процесса следующая:
— удаление избыточного экссудата;
— необратимая элиминация бактерий, токсинов, раневого детрита, грязи, инородных тел;
— стимуляция регидратации некротизированных участков и ускорение некролиза;
— поглощение экссудата структурой материала повязки и прочное его удержание [18].
На каждой перевязке рану очищают от гноя и секвестров, иссекают некротизированные ткани и промывают антисептиками. В настоящее время для промывания paны применяются также озонированные солевые растворы. Для ускорения некролиза используются протеолитические ферменты, ультразвуковая кавитация, вакуумная обработка раны, обработка пульсирующей струей и другие уже упоминавшиеся физические методы воздействия [19].
Во II фазе раневого процесса наряду с подавлением остающихся в небольшом количестве микроорганизмов или вновь появившихся госпитальных штаммов вследствие нарушения асептики и антисептики в момент перевязок препарат должен обеспечивать оптимальные условия для роста грануляций [4]. Роль повязки во II фазу раневого процесса:
— поддержание и регулирование влажной среды в ране;
— обеспечение адекватного кондиционирования раны;
— защита грануляционной ткани от механического повреждения при перевязке;
— надежная защита от вторичной инфекции.
В фазу образования, реорганизации рубца и эпителизации при выборе того или иного лекарственного средства главным является обеспечение оптимальных условий для регенерации. Для этого необходимо создать гипоадгезивный слой повязки, который поддерживает гидратацию и газообмен в гранулирующей ткани и предохраняет ее от повреждения при очередной перевязке. При высыхании раны образуется корка, замедляющая эпителизацию, а при избыточной влажности погибают эпителиальные клетки. Из этого следует, что повязки по-прежнему должны поддерживать рану в умеренно влажном состоянии и защищать от повреждения, поэтому на данной стадии раневого процесса показаны облепиховое и шиповниковое масла, аэрозоли, мази, содержащие глюкокортикостероидные гормоны и антибактериальный компонент. Используют также мази на жировой основе для предотвращения травмирования молодого эпидермиса, а также различные салфетки на трикотажной основе, оказывающие умеренное дегидратирующее действие, благотворно влияющее на рост грануляций и эпителизацию [1]. Роль повязки в III фазу раневого процесса:
— поддержание раны в умеренно влажном состоянии;
— защита эпителия и формирующегося рубца от механического повреждения при перевязке;
— стимуляция регенерации [2].
Выбор перевязочного средства в зависимости от типа раны
Поскольку технология изготовления повязок усложняется, они становятся все более специфичными. На современном этапе развития ни одна из повязок не может быть одинаково пригодна для лечения всех типов ран, как и несколько разных повязок не могут одинаково эффективно лечить одну и ту же рану на протяжении всех стадий ее заживления. Таким образом, выбор повязки для лечения раны с учетом ее особенностей, стадии раневого процесса, наличия осложнений должен быть основан на понимании механизма гистогенеза, регуляции процессов репаративной регенерации.
Перевязочные средства для лечения незаживающих ран
При лечении ран любого характера, в том числе хронических, важную роль играет правильный подбор перевязочного материала.
Перевязочный материал для незаживающих ран должен быть:
•гигроскопичным;
•«дышащим»;
•эластичным и гибким – носить перевязку придется в течение долгого времени, поэтому она не должна мешать движениям.
Компания Биотекфарм предлагает широкий выбор перевязочных материалов для ведения ран любой сложности и на любой стадии. Так, для ран, в которых имеются фрагменты некротизированной ткани или кровоизлияние, подойдет повязка Парапран с химотрипсином – лекарственное средство, входящее в состав повязки, помогает расщеплять некротизированные ткани, способствуя очищению раны.
Для увлажнения «сухих» хронических ран (пролежни, трофические язвы) и ускорения их заживления рекомендуется использовать повязку «ГелеПран» с мирамистином или коллоидным серебром. Это мягкая прозрачная повязка, на 70% состоящая из воды, увлажняет поверхность раны, а содержащееся в ней лекарственное средство (мирамистин или серебро) обеззараживает и способствует регенерации.
Для лечения инфицированных ран подойдут бактерицидные повязки Воскопран с мазью Повидон-йод, антимикробные повязки Воскопран с мазью Диоксидин и противовоспалительные повязки Воскопран с мазью Левомеколь. Повязки Полипран с Диоксидином отлично подходят для профилактики инфицирования ран на стадии грануляции.
Стимулировать регенерацию поможет повязка Хитопран на основе нановолокон хитозана. Она обеспечивает оптимальные условия для заживления – достаточную влажность, воздухопроницаемость и защиту от повреждений, способствует скорейшему росту собственных клеток. Стоит обратить внимание на то, что эту повязку не нужно снимать – она резорбирует самостоятельно по мере заживления раны.
Сроки заживления ран и последствия
Заживление хронической раны – долгий и сложный процесс, который может занять от 1 до 3 месяцев, в зависимости от глубины и размера раны. Следует иметь в виду, что эпителизация хронических ран идет очень медленно – не больше 1 см в месяц. После полной эпителизации «новая» кожа наращивает прочность еще в течение 6 месяцев.
Рекомендации по уходу за проблемной областью достаточно просты:
•беречь рану от сдавливания и механических повреждений;
•регулярно менять повязку (в зависимости от стадии заживления и вида повязки);
•на стадии грануляции – использовать повязки, ускоряющие заживление.
Защита организма
Образование нерастворимого фибрина позволяет защитить организм от кровопотери, а также от воспалительных процессов. Однако подобная реакция вызывает боль и отечность, повреждение тканей, нарушение их функциональности. Впоследствии это устраняется репаративными процессами. На их ранней стадии вырабатываются специальные вещества, которые вызывают деполимеризацию фибрина. Подобная реакция даже в самом начале воспалительного процесса способна тормозить воздействие белка на патологический очаг.