Спектр клинических проявлений герпес-вирусной инфекции (ГВИ) отличается значительным разнообразием. Они зависят от локализации патологического процесса, его распространенности, состояния противовирусного звена иммунного ответа. Вирусы простого герпеса 1-го и 2-го типов наиболее часто поражают кожные покровы, слизистые оболочки, центральную нервную систему. Кроме того, клинические проявления ГВИ определяют:
1) особенности вируса простого герпеса (ВПГ): его типа, антигенности и вирулентности;
2) локализацию поражения (тканевое или органное);
3) стадию и фазу заболевания (обострение или ремиссии);
4) тяжесть течения и длительность инфекционного процесса;
5) пол, возраст и степень иммунокомпетентности пациента;
6) проводимую терапию.
Одна из наиболее распространенных локализаций поражения ВПГ — урогенитальный тракт. Генитальный герпес встречается во всех популяционных группах, и самая высокая заболеваемость зарегистрирована в возрасте 20—29 лет, а второй пик приходится на возраст 35—40 лет [1—3].
ВПГ проникает в организм через кожу или слизистые оболочки путем прямого контакта с естественными барьерами и/или биологическими жидкостями инфицированного человека. Показано, что заражение может происходить от инфицированного пациента вне зависимости от наличия или отсутствия симптомов заболевания. Только 10—25% серопозитивных по отношению к ВПГ людей имеют анамнез генитального герпеса, что предполагает наличие у большинства людей нераспознанной атипичной или бессимптомно протекающей инфекции. В 70% случаев инфицирование генитальным герпесом происходит при контакте с партнером, имеющим бессимптомную форму ГВИ [1, 3].
Существует несколько классификаций ГВИ, которые отражают различные варианты течения и формы заболевания. Все они учитывают основные виды клинических проявлений генитального герпеса (Н.В. Шперлинг и соавт., 2010) [4]:
— первичная;
— рецидивирующая:
— легкое течение — частота рецидивов 1—2 раза в год, ремиссия не менее 6 мес;
— средней степени тяжести — частота рецидивов 3—5 раз в год, ремиссия не менее 3 мес;
— тяжелое течение — частота рецидивов более 6 раз в год, ремиссия от нескольких дней до 6 нед;
— бессимптомная.
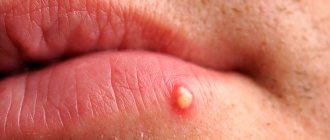
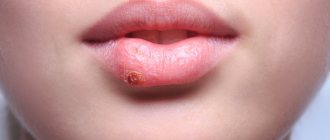
При первичном инфицировании поражения часто имеют множественную локализацию, сопровождаются увеличением и болезненностью паховых лимфатических узлов. Следует отметить, что первый клинический эпизод генитального герпеса является истинным проявлением первичной ГВИ, если пациент ранее никогда не отмечал у себя симптомов заболевания, а в его крови отсутствуют антитела к ВПГ. Инкубационный период первичного герпеса половых органов колеблется от 2 до 12 дней (в среднем 6 дней). Типичная картина проявлений генитального герпеса характеризуется появлением на слизистых оболочках половых органов и прилежащих участках кожи единичных или множественных везикулезных элементов, возникающих на эритематозном фоне. Через 1—2 дня везикулы вскрываются, образуя мокнущие эрозии, реже язвочки, эпителизирующиеся под коркой или без ее образования. У людей обоих полов первичная атака обычно протекает тяжело, с выраженными симптомами общей интоксикации: у большинства пациентов отмечается лихорадка, недомогание, чувство ломоты в мышцах, головная боль. Вирусные частицы выделяются из инфицированных тканей 10—12 дней. Длительность острого периода при первичном генитальном герпесе может достигать 10 дней. Однако в большинстве случаев инфицирование протекает скрытно, переходя сразу в латентный период [1, 3, 5].
Типичные поражения у мужчин располагаются на коже лобковой области, теле полового члена или в перианальной области. Реже высыпания появляются на головке полового члена, венечной борозде, мошонке, в промежности, на бедрах или ягодицах. Герпетические поражения у женщин могут находиться на половых губах, коже промежности, перианальной и ягодичной областей. При присоединении вторичной бактериальной инфекции возможны поражения шейки матки в виде диффузного воспаления с эрозиями, больших изолированных язв и иногда тяжелых некротических изъязвлений.
У большинства женщин и мужчин при первичном генитальном герпесе возникают дизурические расстройства. Сильная боль и деструкция тканей могут вызвать задержку мочи (синдром Элеберга) [3, 5].
Помимо описанного, к первичному эпизоду относят те случаи заболевания, при которых первые клинические проявления развиваются на фоне серопозитивности к ВПГ-инфекции. Симптоматика при этом, как правило, менее интенсивна, чем при истинном первичном герпесе, но более выражена, чем при рецидивирующей форме болезни [3].
Вторичная герпес-вирусная инфекция встречается у больных любого возраста, перенесших первичный герпес. Реактивация ВПГ происходит обычно в первые несколько месяцев после первичного эпизода заболевания. Проявления рецидива генитального герпеса могут быть различными: от бессимптомного выделения вируса или легких симптомов до очень болезненных сливных изъязвлений с четкими границами. В большинстве случаев рецидивирующего генитального герпеса клинические симптомы последующих обострений менее тяжелые и продолжительные по сравнению с первичным эпизодом. Продромальная фаза, включающая зуд, жжение или кожную гиперчувствительность в местах последующих поражений, наблюдается приблизительно у половины больных с рецидивирующим герпесом половых органов. Частота рецидивов у мужчин и женщин, как правило, одинакова, однако их проявления различны. У мужчин рецидивы длятся дольше и характеризуются наличием большего числа очагов поражения, чем у женщин, в то время как у женщин клиническая симптоматика более острая, чем у мужчин [1, 3].
С увеличением длительности заболевания и под воздействием местной терапии клиническая картина генитального герпеса часто изменяется. Высыпания в очаге поражения могут миновать отдельные стадии развития. Сохраняются лишь эрозии, папулезные элементы и отечные пятна на фоне эритемы. При атипичных формах генитального герпеса характерные очаги поражения на слизистых оболочках и коже гениталий могут отсутствовать, отмечаются лишь гиперемия и диффузный отек слизистой, редко возникают рецидивирующие болезненные трещины. Описана также рецидивирующая форма генитального герпеса, для которой характерен лишь зуд, а в ряде случаев субъективные ощущения отсутствуют.
Распространена также бессимптомная форма генитального герпеса (60% от всех случаев), которая характеризуется реактивацией ВПГ без развития классических симптомов заболевания. Важно, что именно больные с бессимптомным генитальным герпесом чаще всего становятся источником инфицирования для своих половых партнеров [1, 3, 5].
При рецидиве ГВИ во время беременности риск передачи вируса новорожденному и развития заболевания невелик. Первичный же эпизод генитального герпеса у беременной может стать причиной трансплацентарной передачи вируса плоду, при этом исход первичной ГВИ во многом определяется сроком гестации, на котором произошло инфицирование [2].
Частые рецидивы, вызывающие дискомфорт в области половых органов, небольшая эффективность многих назначенных схем лечения нередко приводят к значительному ухудшению физического и психического состояния пациентов. У больных генитальным герпесом нередко отмечают депрессию, гневливость, уменьшение чувства собственного достоинства и враждебность к человеку, послужившему вероятным источником заражения. Таким образом, у пациентов с генитальным герпесом отмечается рост психосексуальных и социальных психических расстройств [3].
Задачами лечения рецидивирующей ГВИ являются сокращение частоты обострений, уменьшение их выраженности и длительности, улучшение качества жизни пациентов, а также предупреждение инфицирования половых партнеров и новорожденного.
Основным направлением в лечении является применение высокоспецифичных противовирусных препаратов — ациклических нуклеозидов, которые блокируют репликацию ВПГ. В настоящее время, согласно международным стандартам лечения герпес-вирусных инфекций, препаратами выбора являются ацикловир, валацикловир и фамцикловир [6—8].
Ацикловир — первый противовирусный препарат системного действия — проявляет свою активность против клеток, пораженных ВПГ. Поскольку ацикловир является аналогом 2’-деоксигуанозина, для функционирования ему необходима активация клеточной тимидинкиназой, измененной вирусом, с последующим его превращением в ацикловир-трифосфат. Такая форма ацикловира необратимо, конкурентно с деоксигуанозинтрифосфатом, ингибирует ДНК-полимеразу вируса, что предотвращает возможность элонгации цепи вирусной ДНК. Отсутствие в здоровой клетке специфических изменений, вызванных ферментом вируса, превращающим исходную форму ацикловира в ацикловир-трифосфат, обусловливает специфичность действия ацикловира.
К сожалению, при высокой избирательности действия ацикловира его биодоступность при пероральном приеме остается весьма низкой. В связи с этим для достижения желаемого эффекта в клинической практике зачастую приходится назначать достаточно высокие дозы данного препарата. Именно поэтому пероральное использование ацикловира ограничено при лечении тяжелых стадий заболеваний, вызванных вирусами герпеса.
В отличие от противовирусного препарата первого поколения ацикловира, валацикловир имеет исключительно высокую биодоступность, превышающую аналогичный параметр ацикловира в 3—5 раз. Кроме того, даже при пероральном применении средства его уровень в плазме крови достигает высоких величин, сравнимых со значениями, полученными при введении ацикловира в вену. Такое свойство валацикловира обусловлено его химической структурой. Ее уникальность заключается в том, что валацикловир представляет собой соединение L-валина и ацикловира эфирной связью. Эта особенность позволяет доставлять проацикловир в неизмененном виде в плазму крови. Метаболизируясь в печени гидролазой, валацикловир распадается на валин и ацикловир, который в свою очередь уже обладает антивирусным эффектом. Кроме того, некоторая часть валацикловира гидролизуется в тонком кишечнике с высвобождением активной формы ацикловира. Особенности фармакокинетики данного препарата позволяют назначать его вне зависимости от приема пищи.
Выделяют два основных способа применения противовирусных химиопрепаратов: эпизодическое назначение (по мере необходимости, при обострениях ГВИ) и пролонгированная терапия. В первом случае препарат назначают коротким курсом в течение 5—10 дней, во втором пациенты принимают препарат ежедневно в течение нескольких месяцев или лет, не только для купирования данного рецидива, но и для профилактики последующих обострений [7—9].
Эпизодическая терапия предпочтительна для пациентов, имеющих слабо выраженные и редкие обострения инфекционного заболевания. Целью лечения в этом случае является уменьшение выраженности симптомов рецидива. Для наибольшей эффективности прием препарата необходимо начинать во время продромального периода или 1-х суток клинических проявлений. Согласно Российским клиническим рекомендациям, при рецидивах генитального герпеса назначают ацикловир по 200 мг 5 раз в день (или по 400 мг 3 раза в день) в течение 5 дней, или валацикловир 500 мг 2 раза в день в течение 5 дней, или фамцикловир по 125 мг 2 раза в день в течение 5 дней [6] (табл. 1).
Таблица 1. Рекомендуемые схемы применения ациклических нуклеозидов при рецидивирующем простом герпесе (Европейские стандарты диагностики и лечения инфекций, передаваемых половым путем, 2010 г.) [8—10] Примечание. * — уровень доказательности А.
Своевременный прием ациклических нуклеозидов позволяет прервать репликацию вируса, и в таком случае рецидив протекает в абортивной форме. Для своевременного начала приема препаратов пациентам рекомендовано всегда иметь при себе небольшое количество таблеток ациклических нуклеозидов, а в случае рецидива, на стадии предвестников заболевания, принять препарат.
Для пациентов с частотой рецидивов более 6 раз в год рекомендована пролонгированная схема приема противовирусных препаратов. По данным литературы, она эффективна у 70—80% пациентов. Для такой терапии обязательным является индивидуализированный подход, который включает оценку частоты, тяжести обострений у данного пациента, а также его индивидуальные потребности в контроле рецидивов заболевания [7—9].
Супрессивная терапия предпочтительна в случаях частого рецидивирования генитального герпеса, особенно при тяжелом течении обострений. Также подчеркивается целесообразность использования супрессивной схемы лечения при выраженных эмоциональных реакциях пациента на возобновление симптомов заболевания. Применяемые дозировки при использовании супрессивной схемы лечения зависят от клинического течения рецидивов генитального герпеса. В случае, если у пациента с данным заболеванием количество рецидивов не превышает 10 раз в год, суточная доза валацикловира должна составлять 500 мг. При количестве рецидивов более 10 в год используется суточная дозировка валацикловира 1000 мг [7—9].
Преимущества применения валацикловира:
— в отличие от других противовирусных препаратов валацикловир не приостанавливает, а блокирует размножение вируса простого герпеса;
— меньшее количество приема таблеток в сутки улучшает комплаентность терапии у пациента и уменьшает риск пропуска приема препарата, а значит, повышает эффективность лечения и снижает лекарственную нагрузку на организм;
— валацикловир сочетается с большинством лекарственных средств, не влияет на память, внимание и скорость реакции;
— не обладает тератогенными и мутагенными эффектами.
В последнее время на российском рынке появляется большое количество препаратов валацикловира. Одним из таких средств является европейский аналог валациловира — Валвир
. Форма выпуска — таблетки, покрытые пленочной оболочкой, в стандартной дозе 500 мг (валацикловира гидрохлорида гидрат 611, 70 мг), а также в дозе 1000 мг (валацикловира гидрохлорида гидрат 1223, 40 мг). Для изучения препарата проведено исследование его клинической эффективности у пациентов с хронической рецидивирующей герпесвирусной инфекцией (ХРГВИ).
Описание:
Круглые плоскоцилиндрические таблетки белого или почти белого цвета с фаской и риской.
Фармакологическая группа:
противовирусное средство.
Код АТХ:
J05АВ01
Фармакологическое действие
Фармакологические свойства
Фармакодинамика
Механизм действия
Ацикловир
– это синтетический аналог пуринового нуклеозида, который обладает способностью ингибировать invitro и invivo вирусы герпеса человека, включая вирус простого герпеса (ВПГ) 1-го и 2-го типов, вирус ветряной оспы и опоясывающего герпеса (варицелла-зостер вирус, Varicella zoster virus (ВЗВ)), вирус Эпштейна-Барр (ЭБВ) и цитомегаловирус (ЦМВ). В культуре клеток ацикловир обладает наиболее выраженной противовирусной активностью в отношении ВПГ-1, далее в порядке убывания активности следуют ВПГ-2, ВЗВ, ЭБВ и ЦМВ.
Ингибирующее действие ацикловира на вирусы герпеса (ВПГ-1, ВПГ-2, ВЗВ, ЭБВ и ЦМВ) имеет высокоизбирательный характер. Ацикловир не является субстратом для фермента тимидинкиназы неинфицированных клеток, поэтому ацикловир малотоксичен для клеток млекопитающих. Однако тимидинкиназа клеток, инфицированных вирусами ВПГ, ВЗВ, ЭБВ и ЦМВ, превращает ацикловир в ацикловира монофосфат – аналог нуклеозида, который затем последовательно превращается в дифосфат и трифосфат под действием клеточных ферментов. Включение ацикловира трифосфата в цепочку вирусной ДНК и последующий обрыв цепи блокируют дальнейшую репликацию вирусной ДНК.
У пациентов с выраженным иммунодефицитом длительные или повторные курсы терапии ацикловиром могут приводить к появлению резистентных штаммов, поэтому дальнейшее лечение ацикловиром может быть неэффективным. У большинства выделенных штаммов со сниженной чувствительностью к ацикловиру отмечалось относительно низкое содержание тимидинкиназы, а также нарушение структуры вирусной тимидинкиназы или ДНК-полимеразы. Воздействие ацикловира на штаммы вируса простого герпеса (ВПГ) invitro также может приводить к образованию менее чувствительных к нему штаммов. Не установлена корреляция между чувствительностью штаммов вируса простого герпеса (ВПГ) к ацикловиру invitro и клинической эффективностью препарата.
Фармакокинетика
Всасывание
Ацикловир только частично абсорбируется из кишечника. После приема 200 мг ацикловира каждые 4 часа средняя максимальная равновесная концентрация в плазме крови (Сssmax) составляла 3,1 мкМ (0,7 мкг/мл), а средняя равновесная минимальная концентрация в плазме крови (Сssmin) — 1,8 мкМ (0,4 мкг/мл). При приеме внутрь 400 мг и 800 мг ацикловира каждые 4 часа Сssmaxсоставляла 5,3 мкМ (1,2 мкг/мл) и 8 мкМ (1,8 мкг/мл) соответственно, а Сssmin- 2,7 мкМ (0,6 мкг/мл) и 4 мкМ (0,9 мкг/мл), соответственно.
Распределение
Концентрация ацикловира в спинномозговой жидкости составляет приблизительно 50 % от его концентрации в плазме крови.
С белками плазмы крови ацикловир связывается в незначительной степени (9-33 %), поэтому лекарственные взаимодействия вследствие вытеснения из участков связывания с белками плазмы крови маловероятны.
Выведение
У взрослых после приема ацикловира внутрь период полувыведения из плазмы крови составляет около 3 ч. Большая часть препарата выводится почками в неизмененном виде. Почечный клиренс ацикловира значительно превышает клиренс креатинина, что свидетельствует о выведении ацикловира посредством не только клубочковой фильтрации, но и канальцевой секреции. 9-карбоксиметокси-метилгуанин является основным метаболитом ацикловира и составляет около 10-15% дозы, выводимой с мочой. При назначении ацикловира через 1 ч после приема 1 г пробенецида период полувыведения ацикловира и AUC (площадь под фармакокинетической кривой «концентрация — время») увеличивались на 18 и 40 %, соответственно.
Рекомендации по лечению генитального герпеса
Генитальный герпес – заболевание, передающееся половым путем и проявляющееся рецидивирующими поражениями половых органов. Возбудителями являются вирусы простого герпеса, преимущественно типа II, хотя за последние два десятилетия значительно возросла этиологическая роль вируса I типа .
Таблица. Дозы лекарственных препаратов для лечения генитального герпеса
Несмотря на тяжелые клинические проявления первичной инфекции и потенциально опасные осложнения, приводящие к госпитализации и летальным исходам, генитальному герпесу уделяется недостаточное внимание в неспециализированной медицинской литературе. Между тем, распространение заболевания приняло эпидемический характер, что связано с большим количеством недиагностируемых и нелеченных случаев и высокой частотой асимтоматического и субклинического течения (2). Симптоматическим генитальным герпесом в мире страдают 86 млн человек. Общее количество лиц, пораженных вирусом, определить невозможно, однако предполагают, что, например, в США носителем вируса является каждый четвертый-шестой житель (3-4).
Основными средствами для лечения генитального герпеса являются противовирусные препараты из группы аналогов нуклеозидов. Наиболее широко используемым препаратом продолжает оставаться ацикловир, появившийся на мировом фармацевтическом рынке около 20 лет назад. Являясь аналогом нуклеозидов, препарат подвергается фосфорилированию под влиянием вирусной тимидинкиназы, а затем с помощью ферментов клеток хозяина превращается в ди- и трифосфат. Последний выступает субстратом для вирусной ДНК-полимеразы, приводя таким образом к нарушению репликации ДНК-вируса.
Эффективность ацикловира для лечения генитального герпеса показана в многочисленных клинических исследованиях. При приеме внутрь препарат хорошо переносится больными и обладает отличным соотношением польза/риск. Побочные эффекты развиваются менее чем у 10% пациентов и обычно ограничиваются тошнотой рвотой и головной болью (5).
К главным недостаткам ацикловира относятся низкая биодоступность (15-20%) и короткий период полувыведения из тканей (0,7 ч) и плазмы крови (2,7 ч) (5). Для поддержания терапевтических концентраций в организме препарат необходимо принимать до 5 раз в сутки, что отрицательно влияет на аккуратность выполнения пациентами режима лечения и может привести к снижению эффективности терапии.
Фармакокинетические недостатки ацикловира удалось в значительной степени преодолеть при разработке валацикловира – пролекарства, метаболизирующегося в стенке кишечника и печени с образованием ацикловира. Валацикловир обладает значительно большей биодоступностью при приеме внутрь (54%) и обеспечивает более высокие и длительные концентрации ацикловира в сыворотке крови (6-8), что позволяет принимать его дважды в день. При многократном введении валацикловира внутрь в высоких дозах (4-8 г/сут.) концентрации действующего вещества в крови сопоставимы с концентрациями, создающимися при внутривенном введении ацикловира (5-10 мг/кг 3 раза/сут.) (8, 9).
Кинетика ацикловира, высвобождающегося из валацикловира, аналогична кинетике препаратов ацикловира у здоровых добровольцев, пациентов с заболеваниями почек, ВИЧ-инфекцией (10), пожилых больных и добровольцев старческого возраста, как получающих, так и не получающих сопутствующую диуретическую терапию (11).
Профиль безопасности валацикловира существенно не отличается от профиля безопасности ацикловира. Лучшая всасываемость обусловливает меньшую частоту желудочно-кишечных побочных реакций (5). У больных со СПИДом и другими нарушениями иммунитета при применении валацикловира в высоких дозах (8 г/сут.) описана тромботическая микроангиопатия, однако причинно-следственная связь между препаратом и данным осложнением окончательно не подтверждена (12). У пациентов, получавших высокие дозы валацикловира после операции по поводу трансплантации почки, тромботическая микроангиопатия не наблюдалась (13). Кроме того, для лечения генитального герпеса препарат применяют в значительно более низких дозах.
Третий аналог нуклеозидов – фамцикловир – так же, как и валацикловир, является пролекарством, превращающимся в стенке кишечника и в печени в пенцикловир. Пенцикловир обладает сходным с ацикловиром механизмом и спектром противовирусного действия, однако в связи с низкой биодоступностью может использоваться только местно (5). При приеме перорального фамцикловира биодоступность пенцикловира составляет 77% (14). По сравнению с ацикловиром пенцикловир имеет значительно больший период полувыведения из тканей (10-20 ч) (15). Внутриклеточные концентрации пенцикловира трифосфата превышают таковые для ацикловира трифосфата примерно в 30 раз (16). Однако ДНК-полимераза вируса простого герпеса имеет большее сродство с ацикловиром трифосфатом, чем пенцикловиром трифосфатом. Таким образом, различия в механизме действия между пенцикловиром и ацикловиром являются преимущественно количественными и проявляют тенденцию к уравновешиванию друг друга (16).
Ацикловир и пенцикловир не отличаются по активности в отношении вируса простого герпеса в культуре клеток, однако после отмены ацикловира репликация вируса возобновляется значительно быстрее, чем после отмены пенцикловира (13). Фамцикловир превосходит валацикловир по способности устранять «компетентную латентность», т. е. состояние, в котором вирус способен реактивироваться и вызывать рецидивы заболевания (18, 19). В обсервационном исследовании у пациентов, получавших фамцикловир (по 250 мг 3 раза/сут. в течение 5 дней), рецидивы в течение 1-6 месяцев после первого эпизода развивались реже, чем у пациентов, леченных ацикловиром (по 200 мг 5 раз/сут. в течение 5 дней) (20).
Фамцикловир обладает отличным профилем безопасности. Анализ переносимости, основанный на результатах 13 клинических исследований, показал, что профиль побочных реакций фамцикловира у больных с генитальным герпесом (791 пациент) не отличается от плацебо (21). В исследованиях на здоровых мужчинах-добровольцах не выявлено клинически значимых фармакокинетических взаимодействий фамцикловира с аллопуринолом, дигоксином, циметидином, зидовудином или теофиллином (22). Биодоступность пенцикловира, образующегося при метаболизме фамцикловира, не зависит от приема пищи (23). Его фармакокинетика не отличается у лиц молодого и пожилого возраста (24). При приеме в течение 4-12 месяцев здоровыми добровольцами мужского пола препарат не оказывал отрицательного влияния на сперму (25).
Ацикловир, валацикловир и фамцикловир проявляют сопоставимую клиническую эффективность, приводя к уменьшению продолжительности и тяжести эпизодов генитального герпеса и снижению выделения вируса (26-28). Однако они не оказывают влияния на вирусы в стадии покоя.
Лечение
первогоэпизодагенитальногогерпеса
Первым эпизодом первичного генитального герпеса считают клиническое проявление заболевания у пациентов без антител к вирусам простого герпеса I или II типа. Для первого эпизода характерно наиболее тяжелое течение. Как правило, помимо местных поражений, сохраняющихся в течение 2-3 недель, наблюдаются системные симптомы и региональная аденопатия. У небольшого числа пациентов, чаще иммуннокомпрометированных, развивается вирусный менингит.
Симптоматическая терапия первого эпизода заключается в назначении анальгетиков. Следует избегать применения опиоидных препаратов, так как они вызывают запоры. Для этиотропного лечения применяют аналоги нуклеозидов.
Эффективность перорального ацикловира в дозе по 200 мг 5 раз/сут. в течение 5-10 дней показана в двойных слепых плацебоконтролируе-мых клинических исследованиях (29, 30). У больных, получавших ацикловир, достоверно укорачивался период выделения вируса, время образования корочки и время заживления. Повышение пероральной суточной дозы препарата до 4 г не приводило к повышению эффективности терапии (31). Кроме того, при применении высокой дозы значительно чаще развивались желудочно-кишечные побочные эффекты (8%), чем при использовании стандартной дозы (0%).
С целью повышения приверженности пациентов лечению Центр по контролю и профилактике заболеваний США (CDC) рекомендует применять ацикловир по 400 мг 3 раза в сутки, однако эта схема не одобрена FDA. Местное применение ацикловира в форме крема не эффективно (6). Добавление крема к пероральной терапии также не приводило к улучшению клинических результатов (32). В тяжелых случаях с неврологическими осложнениями ацикловир рекомендуют вводить внутривенно по 5-10 мг/кг 3 раза в сутки (5).
Валацикловир в дозе 1 г 2 раза/сут. проявляет равную эффективность с ацикловиром в дозе 200 мг 5 раз/сут. при первом эпизоде генитального герпеса у иммуннокомпетентных больных (33). Переносимость валацикловира аналогична переносимости ацикловира (33). В разных странах для лечения первого эпизода генитального герпеса валацикловир одобрен в дозе по 500 мг или 1 г 2 раза/сут. в течение 10 дней (25).
Фамцикловир изучен в сравнительных клинических исследованиях с ацикловиром (по 200 мг 5 раз/сут.) в дозах по 125, 250 и 500 мг 3 раза в день (27, 28). Ни в одном исследовании не было показано достоверных различий между группами сравнения. Для лечения генитального герпеса фамцикловир рекомендуют назначать по 250 мг 3 раза/сут. в течение 5 дней, при тяжелой инфекции – 10 дней (25).
Эпизодическое
лечениерецидивовгенитальноговируса
В клинических исследованиях при применении ацикловира в стандартной суточной дозе (по 200 мг 5 раз/сут.) для эпизодического лечения рецидивов генитального герпеса отмечалось укорочение периода выделения вируса, времени образования корочки и времени заживления. Продолжительность симптомов и время возникновения новых рецидивов не изменялись под влиянием препарата (28, 34). В рекомендациях по менеджменту генитального герпеса, выпущенных в 1998 г. Центрами по контролю и профилактике заболеваний США (CDC) предложено применение ацикловира в дозах по 400 мг 3 раза/сут. или 800 мг 2 раза/сут. в течение 5 дней. Однако эти схемы лечения не были изучены в адекватных клинических исследованиях.
При местном применении в форме 5%-ой мази на полиэтиленгликоле ацикловир приводил к уменьшению периода выделения вируса, но не вызывал клинического улучшения (6).
Валацикловир в дозе 500 или 1000 мг 2 раза/сут. в течение 5 дней, назначенный в первые сутки после возникновения симптомов, достоверно уменьшал период выделения вируса и ускорял заживление повреждений по сравнению с плацебо (35). Переносимость препарата не отличалась от переносимости плацебо. В одном из исследований было показано, что при применении валацикловира везикуло-ульцеративные поражения развивались у меньшего количества пациентов (на 10%), чем при применении плацебо (25). Результаты другого исследования позволяют предположить на основании естественного периода выделения вируса, что 3-дневный курс лечения валацикловиром не уступает по эффективности 5-дневному (36). В июле 2001 г. FDA одобрило 3-дневный курс лечения рецидивов генитального герпеса валацикловиром (по 500 мг 2 раза/сут.). В сравнительных исследованиях с ацикловиром показана равная клиническая эффективность обоих препаратов (37). Важным преимуществом валацикловира является более удобный режим применения.
Фамцикловир в дозах 125, 250 и 500 мг 2 раза/сут., назначенный в первые 6 часов после возникновения симптомов, приводил к уменьшению времени заживления, периода выделения вируса и продолжительности отечности повреждений по сравнению с плацебо (38). При его применении достоверно уменьшались боль, жжение, покалывание, болезненность при прикосновении. Побочные эффекты фамцикловира не отличались от побочных эффектов плацебо. Фамцикловир рекомендован для эпизодического лечения рецидивов генитального герпеса в дозе по 125 мг 2 раза/сут. в течение 5 дней. Преимущества фамцикловира так же, как и валацикловира, заключаются в более удобной по сравнению с ацикловиром схеме лечения.
Эффективность эпизодического лечения рецидивов генитального герпеса зависит от времени начала приема препаратов. В канадском исследовании показано, что в случае начала приема фамцикловира в первые 6 часов после появления продромальных симптомов или первых генитальных поражений, наблюдалось достоверное уменьшение выделения вируса и более быстрое заживление повреждений. Более того, прием препарата до начала выделения вируса повышал вероятность предупреждения его выделения во время рецидива (39). Лечение рецидива следует начинать как можно быстрее, поэтому пациентам необходимо постоянно иметь запас препарата.
Продолжающаяся
супрессивнаятерапия
Больным с частыми (более 6-8 в год) и тяжелыми рецидивами, психологической травмой или нарушением нормального образа жизни, вызванных заболеванием, показана продолжающаяся супрессивная терапия. С этой целью длительно (в течение 6-12 месяцев) применяют ацикловир по 400 мг 2 раза/сут.; валацикловир по 500 мг 1 раз/сут. (при количестве рецидивов 10 или меньше в год) или по 1000 мг 1 раз/сут. (при количестве рецидивов более 10 в год) или фамцикловир по 250 мг 2 раза/сут. Показано, что ежедневный прием ацикловира уменьшает частоту рецидивов на 80%, у 25-30% пациентов рецидивы не возобновлялись (40). Сходные результаты были получены и в исследованиях с валацикловиром и фамцикловиром. При применении фамцикловира в суточной дозе 500 мг, разделенной на 2 приема, в течение 16 недель рецидивы не развивались в период лечения у 78% больных (41), при применении валацикловира в той же дозе – у 69% больных (33). Все три препарата зарекомендовали себя эффективными средствами для длительной супрессивной терапии рецидивирующего генитального герпеса. По-видимому, решающими факторами при выборе конкретного препарата должна быть стоимость годовой дозы и удобство режима применения для пациента.
Супрессивная терапия хорошо переносится. Ее безопасность была доказана при ежедневном использовании в течение 5 лет (42). Однако перед назначением супрессивной терапии рекомендуется провести гематологические и биохимические исследования и определить состояние функции почек. В период лечения пациенты должны находиться под наблюдением врача, женщинам рекомендовано избегать беременности.
Ежедневная супрессивная терапия приводит к значительному уменьшению асимптоматического выделения вируса, но не позволяет его полностью ликвидировать. Следует предупредить пациента при решении вопроса о ее назначении. В качестве альтернативы пациенту следует предложить селективную профилактику (например, в периоды стресса). На сегодняшний день снижение риска передачи инфекции под влиянием супрессивной терапии не доказано.
Независимо от того, проводится ли супрессивное лечение или нет, частота рецидивов уменьшается в среднем через 7 лет после первого эпизода, поэтому обычно нет необходимости в пожизненном лечении.
Лечение
генитальногогерпесаубеременных
У женщин, страдающих генитальным герпесом в период беременности, повышен риск спонтанных абортов и рождения детей с пониженным весом. В редких случаях возможно развитие врожденной инфекции у плода. Наиболее высок риск заражения в период прохождения ребенка по родовым путям. Риск передачи инфекции оценивается в 50% при первичном герпесе матери во время родов и в 0-3% – при рецидивирующем герпесе (43). Наиболее часто заражение происходит от асимптоматичных матерей (44).
У новорожденных заболевание протекает в трех основных формах: локализованной, с поражением центральной нервной системы и диссеминированной. Смертность составляет 15% при инфекции с вовлечением центральной нервной системы и 57% – при диссеминированной форме (45 ).
С целью уменьшения риска субклинического выделения вируса и эпизодов рецидивов во время родов многие клиницисты рекомендуют проводить беременным супрессивную противовирусную терапию. Аналоги нуклеозидов официально не одобрены для применения в период беременности, однако во многих исследованиях показана безопасность ацикловира (46, 47). Валацикловир и фамцикловир, по классификации FDA, относят к группе В, т. е. к препаратам, для которых не выявлено тератогенного эффекта в экспериментах на животных, а адекватные клинические испытания на людях не проводились. В настоящее время проходят исследования по определению эффективности и безопасности валацикловира в период беременности.
Данные об эффективности супрессивной терапии в отношении предупреждения инфекции у плода крайне ограничены. В рандомизированном исследовании, включавшем 46 женщин с первым эпизодом генитального герпеса, не удалось определить эффективность лечения ацикловиром, начатого на 36-ой неделе беременности, так как инфекция не развилась ни у одного новорожденного. Однако в группе больных, получавших супрессивную терапию, отмечено значительное снижение частоты кесарева сечения (48). В другом плацебоконтролируемом исследовании, включавшем 150 женщин с генитальным герпесом в анамнезе (49), было показано, что ацикловир (200 мг 3 раза/сут.), принимаемый с 38-ой недели беременности, способен предотвращать рецидивы заболевания. У пациенток, получавших ацикловир, рецидив не возник ни в одном случае, в то время как в контрольной группе наблюдалось 33 рецидива, из них 21 – в период родов.
Лечение
генитальногогерпеса,вызванногоацикловир—резистентнымиштаммами
Длительное лечение аналогами нуклеозидов, как правило, не сопряжено с риском развития вирусной резистентности. У иммунокомпетентных больных, получавших супрессивную терапию, выделяли ацикловир-резистентные штаммы вируса простого герпеса, однако корреляции между резистентностью in vitro
и терапевтической эффективностью препарата не наблюдалось (25). Наиболее распространенным механизмом развития резистентности является генная мутация, приводящая к нарушению выработки тимидинкиназы (50), поэтому ацикловир-резистентные штаммы обычно проявляют перекрестную устойчивость к пенцикловиру. Значительно реже встречаются мутации, приводящие к нарушению функции тимидинкиназы и ДНК-полимеразы (50, 51). В этих случаях возможна селективная резистентность к одному из препаратов. Математические методы анализа позволяют предположить, что для изменений существующей модели резистентности вируса необходимы десятилетия (52).
У иммуннокомпрометированных больных при длительном применении противовирусных препаратов резистентность развивается примерно в 5% случаев и может приводить к неудаче лечения (53, 54). Клинически значимая резистентность также описана у пациентов, перенесших трансплантацию костного мозга (55).
В настоящее время в качестве препарата выбора для лечения ацикловир-резистентных инфекций, вызванных герпесом простого вируса, рассматривается фоскарнет (56). Он относится к неконкурентным ингибиторам вирусной ДНК-полимеразы. Препарат блокирует рецепторы связывания с пирофосфатом вирусной ДНК и нарушает удлинение ее цепочки. В отличие от ацикловира и пенцикловира он не нуждается в фосфорилировании с участием тимидинкиназы и проявляет активность в отношении ацикловир-резистентных тимидинкиназодефицитных штаммов (56).
Фоскарнет отличается низкой биодоступностью при приеме внутрь, поэтому вводится внутривенно и местно. Эффективность внутривенного фоскарнета при генитальном герпесе, вызванном ацикловир-резистентными штаммами, была показана в нескольких клинических исследованиях. В неконтролируемом исследовании препарат оказался эффективным у 81% больных ацикловир-резистентным генитальным герпесом, развившимся на фоне ВИЧ-инфекции (57). В другом исследовании у больных ВИЧ-инфекцией фоскарнет превосходил видарабин в отношении времени заживления герпесных слизистокожных поражений, вызванных ацикловир-резистентными штаммами, и периода прекращения выделения вируса (58). При местном применении препарат не проявлял достаточной эффективности (25).
Фоскарнет является потенциально токсичным средством. Побочные эффекты включают нарушение функции почек, желудочно-кишечные расстройства, нарушения метаболизма магния и кальция, анемию, изъязвление половых органов и судороги (59). Для профилактики серьезных побочных эффектов лечение необходимо проводить под тщательным наблюдением врача, поддерживать адекватный уровень гидратации, избегать одновременного назначения пентамидина.
Применение фоскарнета ограничивает внутривенный путь введения. К нему может развиваться устойчивость вследствие мутации ДНК-полимеразы (60). Описаны клинические штаммы вируса простого герпеса, резистентные одновременно к ацикловиру и фоскарнету (61).
Выраженную активность в отношении герпеса простого вируса in vitro
и
in vivo
проявляет цидофовир (62, 63). Он является ациклическим аналогом фосфаната и обладает широким спектром противовирусной активности. Препарат подвергается фосфорилированию под влиянием клеточных ферментов в активный дифосфат, минуя первый этап фосфорилирования с участием ферментов вируса, необходимый для ацикловира и пенцикловира (64). Цидофовир обладает низкой биодоступностью при приеме внутрь (менее 5%), что позволяет использовать его только местно. Достоинством является длительный период полувыведения из клетки. Внутриклеточные концентрации моно- и дифосфата цидофовира поддерживаются в течение 24 и 65 часов соответственно (65).
Эффективность однократной дозы препарата в сравнении с плацебо была показана у иммуннокомпетентных пациентов с рецидивирующим генитальным герпесом (66). В данном исследовании через 12 часов после появления первых поражений пациенты получали гель цидофовира в концентрации 1,3 или 5% или плацебо. Местные токсические реакции препарата замедляли у ряда больных заживление повреждений. Они носили дозозависимый характер и наблюдались у трех из 23 пациентов, леченных 5%-ным гелем, и у 1 из 21 пациентов, леченных 3%-ным гелем. Для определения максимальной концентрации геля, хорошо переносимой больными, необходимы дальнейшие исследования
В клиническом плацебоконтролируемом исследовании гель цидофовира, наносимый 1 раз в сутки в течение 5 дней, проявлял выраженный вирусологический и клинический эффект у больных с ацикловир-резистентным генитальным герпесом на фоне ВИЧ-инфекции (67). Полное устранение клинических симптомов наблюдалось у 27% пациентов, получавших 0,3%-ный цидофовир, у 33% – получавших 1% цидофовир и у 0% пациентов, получавших плацебо. Медиана уменьшения площади повреждения составила 58% у больных, леченных цидофовиром, по сравнению с 0% в контрольной группе. К сожалению, небольшое количество пациентов, участвовавших в данном исследовании, не позволяет оценить статистическую достоверность полученных результатов.
В клиническом исследовании у пациентов, перенесших трансплантацию костного мозга, цидофовир был эффективен при генитальном герпесе, вызванном штаммами вируса, резистентными к ацикловиру и фоскарнету (61).
Существует опыт использования офтальмологического раствора тифлуридина для лечения генитального герпеса, вызванного ацикловир-резистентными штаммами ( ). Тифлуридин представляет собой пиримидиновый нуклеозидный аналог, действие которого, подобно цидофиру, независимо от вирусной тимидинкиназы. Высокая токсичность не позволяет принимать препарат внутрь. В небольших клинических исследованиях показан благоприятный эффект тифлуридина при ацикловир-резистентном генитальном герпесе у больных ВИЧ-инфекцией (68). При инфекции, вызванной ацикловир- или ацикловир/фоскарнет-резистентными вирусами простого герпеса тифлуридин проявлял синергидный эффект с интерфероном-a (69). Однако для определения терапевтической ценности тифлуридина при генитальном герпесе необходимо его дальнейшее изучение в больших контролируемых исследованиях.
В нескольких исследованиях по изучению эффективности наружных лекарственных форм интерферона для лечения генитального герпеса были получены противоречивые результаты. Местное нанесение интерферона α-2a 6 раз/сут. в форме водного раствора оказалось неэффективным для лечения герпесных генитальных повреждений (70). В плацебоконтролируемом исследовании, включавшем 387 пациентов, напротив, показана эффективность геля интерферона α-2a при применении 4 раза/сут. в течение 4 дней при рецидиве генитального герпеса (71). У пациентов обоего пола уменьшался период выделения вируса, кроме того, у мужчин отмечалось достоверное уменьшение боли, зуда и времени образования корочки. В исследовании, включавшем 25 больных, был показан благоприятный эффект интерферона ß (72).
В Германии и Канаде для лечения генитального герпеса одобрен эдоксудин – аналог деокситимидина, проявляющий выраженную антигерпесную активность in vitro
и
in vivo
(73, 74). Механизм действия препарата сходен с ацикловиром. При местном применении он лучше всасывается, чем мазь ацикловира на полиэтиленгликолевой основе. В многоцентровом плацебоконтролируемом исследовании 3%-ный крем эдоксудина, наносимый в течение 5 дней, существенно снижал выделение вируса у пациентов обоего пола (75). У женщин также наблюдалось уменьшение болезненности и аденопатии в паховой области.
Разработана лекарственная форма ацикловира с контролируемым выделением действующего вещества (76). Ее преимуществом является удлинение периода полувыведения ацикловира. Клинические испытания, проводимые в Европе, свидетельствуют о равной эффективности ацикловира пролонгированного действия с ацикловиром короткого действия. Высказывается предположение, что применение препарата с удлиненным периодом полувыведения может привести к снижению количества рецидивов при супрессивной терапии, однако оно требует изучения в дальнейших исследованиях.
В экспериментах на морских свинках и в клиническом исследовании показан благоприятный эффект резиквимода – модификатора иммунного ответа из группы имидазохинолинов (77, 78). У больных генитальным герпесом в случае, когда местное лечение начинали в течение суток после возникновения симптомов, наблюдалось удлинение времени до возникновения рецидива. У 52 иммуннокомпетентных больных, имеющих в анамнезе не менее 6 рецидивов заболевания в год, медиана времени до возникновения первого рецидива составила 169 дней при применении резиквимода и 57 дней – плацебо (79). В настоящее время препарат проходит III фазу клинических испытаний.
Несмотря на успехи в лечении генитального герпеса, достигнутые за последние несколько лет, эпидемия заболевания продолжает распространяться во всем мире. Основными препаратами для лечения инфекции являются аналоги нуклеозидов. Появление генерических препаратов ацикловира позволило значительно снизить стоимость лечения. Новые средства из этой группы – пролекарства валацикловир и фамцикловир – обладают лучшими фармакокинетическими свойствами по сравнению с ацикловиром, что позволяет повысить степень соблюдения пациентами режима лечения. При лечении первого эпизода генитального герпеса препараты проявляют сопоставимую клиническую эффективность.
Непосредственных сравнительных исследований между тремя аналогами нуклеозидов при эпизодическом лечении рецидивов генитального герпеса не проводились. По-видимому, подбор противовирусного средства должен быть индивидуальным. Для выявления предпочтений пациента следует попробовать (не одновременно) все три препарата.
Эпизодическое лечение подходит не для всех больных. В связи с хорошей эффективностью и безопасностью в настоящее время все более широкое распространение получает супрессивная терапия. Высказано предположение, что супрессивная терапия, снижая асимптоматическое выделение вируса, может приостановить распространение инфекции, однако на сегодняшний день оно не доказано. Для супрессивной терапии успешно применяют ацикловир. Он не уступает по эффективности валацикловиру. Однократный прием валацикловира в сутки удобен для пациентов с редкой частотой рецидивов. Сравнительные исследования ацикловира и фамцикловира не проводились.
Рецидивы заболевания могут развиваться и на фоне супрессивной терапии, что связывают с коротким периодом полувыведения противовирусных средств. При отмене супрессивной терапии возможно повышение риска передачи инфекции. Этот вопрос необходимо изучить в специальных клинических исследованиях. До получения результатов этих исследований супрессивную терапию следует отменять осторожно, консультируя пациента по поводу безопасности сексуального поведения.
Показания к применению
— Лечение инфекций кожи и слизистых оболочек, вызванных вирусом простого герпеса, включая первичный и рецидивирующий генитальный герпес;
— профилактика рецидивов инфекций, вызванных вирусом простого герпеса, у пациентов с нормальным иммунным статусом;
— профилактика инфекций, вызванных вирусом простого герпеса, у пациентов с иммунодефицитом;
— лечение ветряной оспы и опоясывающего герпеса (раннее лечение опоясывающего герпеса ацикловиром оказывает анальгезирующий эффект и может снизить частоту возникновения постгерпетической невралгии).
Применение при беременности и лактации.
Фертильность
Нет данных о влиянии ацикловира на женскую фертильность.
В исследовании с участием 20 пациентов мужского пола с нормальным количеством сперматозоидов было установлено, что применение ацикловира внутрь в дозе до 1 г в сутки в течение 6 месяцев не имело клинически значимого влияния на количество, подвижность или морфологию сперматозоидов.
Беременность
В пострегистрационном реестре беременностей при лечении ацикловиром собраны данные об исходах беременности у женщин, принимавших ацикловир в разных лекарственных формах. При анализе данных реестра не было отмечено увеличения количества врожденных дефектов у новорожденных, матери которых принимали ацикловир во время беременности, по сравнению с общей популяцией. Выявленные врожденные дефекты не отличались единообразием или закономерностью, позволяющими предположить общую причину их возникновения.
Однако следует соблюдать осторожность при назначении препарата Ацикловир женщинам в период беременности и оценивать предполагаемую пользу для матери и возможный риск для плода.
Период грудного вскармливания
После приема препарата Ацикловир внутрь в дозе 200 мг 5 раз в сутки ацикловир определялся в грудном молоке в концентрации, составляющей от 60 до 410 % плазменной концентрации. При таких концентрациях в грудном молоке дети, находящиеся на грудном вскармливании, могут получать ацикловир в дозе до 0,3 мг/кг/сут. Учитывая это, следует соблюдать осторожность при назначении препарата Ацикловир кормящим женщинам.
Способ применения и дозы
Препарат Ацикловир, таблетки можно принимать во время еды, поскольку прием пищи не нарушает в значительной степени его абсорбцию. Таблетки следует запивать полным стаканом воды.
Взрослые
Лечение инфекций кожи и слизистых оболочек, вызванных вирусом простого герпеса, включая первичный рецидивирующий генитальный герпес
Для лечения инфекций, вызванных вирусом простого герпеса, рекомендуемая доза препарата Ацикловир составляет 200 мг внутрь 5 раз в сутки (каждые 4 часа, за исключением периода ночного сна). Курс лечения составляет 5 дней, но может быть продлен при тяжелых первичных инфекциях.
В случае выраженного иммунодефицита (например, после трансплантации костного мозга) или при нарушении всасывания из кишечника доза препарата Ацикловир, может быть увеличена до 400 мг. В качестве альтернативы может быть рассмотрена возможность применения ацикловира в лекарственной форме лиофилизат для приготовления раствора для инфузий.
Лечение необходимо начинать как можно раньше после возникновения инфекции; при рецидивах препарат рекомендуется назначать уже в продромальном периоде или появлении первых элементов сыпи.
Профилактика рецидивов инфекций, вызванных вирусом простого герпеса, у пациентов с нормальным иммунным статусом
Для профилактики рецидивов инфекций, вызванных вирусом простого герпеса, у пациентов с нормальным иммунным статусом рекомендуемая доза препарата Ацикловир составляет 200 мг внутрь 4 раза в сутки (каждые 6 часов).
Многим пациентам подходит более удобная схема терапии 400 мг внутрь 2 раза в сутки (каждые 12 часов).
В ряде случаев оказываются эффективными более низкие дозы препарата Ацикловир: 200 мг внутрь 3 раза в сутки (каждые 8 часов) или 200 мг внутрь 2 раза в сутки (каждые 12 часов).
У некоторых пациентов может произойти обострение инфекции при приеме суммарной суточной дозы 800 мг.
Лечение препаратом Ацикловир следует прерывать через каждые 6-12 месяцев для выявления возможных изменений в течении заболевания.
Профилактика инфекций, вызванных вирусом простого герпеса, у пациентов с иммунодефицитом
Для профилактики инфекций, вызванных вирусом простого герпеса, у пациентов с иммунодефицитом рекомендуемая доза препарата Ацикловир составляет 200 мг внутрь 4 раза в сутки (каждые 6 часов).
В случае выраженного иммунодефицита (например, после трансплантации костного мозга) или при нарушении всасывания из кишечника доза препарата может быть увеличена до 400 мг внутрь. В качестве альтернативы может быть рассмотрена возможность применения ацикловира в лекарственной форме лиофилизат для приготовления раствора для инфузий.
Продолжительность профилактического курса терапии определяется длительностью периода, в течение которого существует риск инфицирования.
Лечение ветряной оспы и опоясывающего герпеса
Для лечения ветряной оспы и опоясывающего герпеса рекомендуемая доза препарата Ацикловир составляет 800 мг внутрь 5 раз в сутки (каждые 4 часа, за исключением периода ночного сна). Курс лечения составляет 7 дней.
Лечение опоясывающего герпеса следует начинать как можно раньше от момента первых проявлений заболевания, так как в этом случае лечение будет более эффективным.
Лечение ветряной оспы у пациентов с нормальным иммунным статусом следует начать в течение 24 часов с момента появления высыпаний.
У пациентов с тяжелым иммунодефицитом (например, после трансплантации костного мозга) или при нарушении всасывания из кишечника необходимо рассмотреть возможность назначения ацикловира в лекарственной форме лиофилизат для приготовления раствора для инфузий.
Особые группы пациентов
Дети в возрасте от 3 лет и старше
Лечение инфекций, вызванных вирусом простого герпеса; профилактика инфекций, вызванных вирусом простого герпеса, у пациентов с иммунодефицитом
— в возрасте от 3 лет и старше – такие же дозы, как для взрослых.
Лечение ветряной оспы
— в возрасте от 6 лет и старше — 800 мг внутрь 4 раза в сутки;
— в возрасте от 3 до 6 лет — 400 мг внутрь 4 раза в сутки.
Более точно дозу можно определить из расчета 20 мг/кг массы тела (но не более 800 мг) внутрь 4 раза в сутки. Курс лечения составляет 5 дней.
Профилактика рецидивов инфекций, вызванных вирусом простого герпеса, у пациентов с нормальным иммунным статусом; лечение опоясывающего герпеса
Данные о режиме дозирования отсутствуют.
Пациенты пожилого возраста
Необходимо учитывать вероятность наличия почечной недостаточности у пациентов пожилого возраста, дозы должны быть скорректированы в соответствии со степенью почечной недостаточности (см. подраздел «Пациенты с нарушением функции почек»).
Необходимо обеспечить поддержание адекватного водного баланса.
Пациенты с нарушением функции почек
Необходимо соблюдать осторожность при назначении препарата Ацикловир пациентам с нарушением функции почек.
Необходимо обеспечить поддержание адекватного водного баланса.
У пациентов с почечной недостаточностью прием ацикловира внутрь в рекомендуемых дозах с целью лечения и профилактики инфекций, вызванных вирусом простого герпеса, не приводит к кумуляции препарата до концентраций, превышающих установленные безопасные уровни. Однако у пациентов с клиренсом креатинина менее 10 мл/мин дозу препарата Ацикловир рекомендуется снижать до 200 мг внутрь 2 раза в сутки (каждые 12 часов).
При лечении ветряной оспы и опоясывающего герпеса рекомендуемые дозы препарата Ацикловир, таблетки составляют:
— при клиренсе креатинина менее 10 мл/мин— 800 мг внутрь 2 раза в сутки (каждые 12 часов);
— при клиренсе креатинина 10- 25 мл/мин — 800 мг внутрь 3 раза в сутки (каждые 8 часов).
Инструкция по применению
Использовать лекарственное средство необходимо строго по инструкции и после консультации лечащего врача. Самолечением заниматься крайне не рекомендуется. Прием противовирусного препарата напрямую зависит от формы выпуска:
- Таблетки. Предназначены для перорального введения. Принимают во время, или после еды по схеме: 5 раз в день по 1 штуке, запивая достаточным объемом воды. В зависимости от показаний и самочувствия больного, терапевтическая доза может быть увеличена до 8 таблеток. Наивысшая суточная норма Ацикловира не должна превышать 10 таблеток.
- Мазь. Используется локально, средство наносят прямо на пораженный участок кожи в небольшом количестве. Частота приема — каждый час до полного исчезновения бородавки. Курс терапии не более 10 дней.
- Порошок для приготовления раствора. Применяется внутрь. Предварительно рекомендуется сдать лабораторные анализы на определение уровня вирусных клеток в организме. Данную форму следует принимать только по назначению специалиста. Продолжительность лечебного курса не более недели.
Если требуется длительная терапия, в этом случае делают минимальный перерыв сроком на 10 дней. После чего врач может продлить лечебный курс по необходимости.
Побочное действие
Приведенные ниже категории частоты нежелательных реакций являются оценочными. Для большинства нежелательных реакций необходимые данные для определения частоты встречаемости отсутствуют. Кроме того, частота встречаемости нежелательных реакций может варьировать в зависимости от показания.
Нежелательные реакции, представленные ниже, перечислены в соответствии с частотой встречаемости, определяемой следующим образом: очень часто (>1/10), часто (>1/100 и <1/10), нечасто (>1/1000 и <1/100), редко (>1/10000 и <1/1000), очень редко (<1/10 000).
Частота встречаемости нежелательных реакций
Нарушения со стороны крови и лимфатической системы
Очень редко: анемия, лейкопения, тромбоцитопения.
Нарушения со стороны иммунной системы
Редко: анафилаксия.
Нарушения со стороны нервной системы и психического статуса
Часто: головная боль, головокружение.
Очень редко: возбуждение, спутанность сознания, тремор, атаксия, дизартрия, галлюцинации, психотические симптомы, судороги, сонливость, энцефалопатия, кома.
Обычно эти побочные эффекты наблюдались у пациентов с почечной недостаточностью или при наличии других провоцирующих факторов и были, в основном, обратимыми (см.раздел «Особые указания»
).
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Редко: одышка.
Нарушения со стороны желудочно-кишечного тракта
Часто: тошнота, рвота, диарея, боль в животе.
Нарушения со стороны печени и желчевыводящих путей
Редко: обратимое повышение концентрации билирубина и печеночных ферментов в крови.
Очень редко: гепатит, желтуха.
Нарушения со стороны кожи и подкожных тканей
Часто: зуд, сыпь, в том числе фотосенсибилизация.
Нечасто: крапивница, быстрое диффузное выпадение волос.
Поскольку быстрое диффузное выпадение волос наблюдается при различных заболеваниях и при терапии многими лекарственными средствами, связь егос приемом ацикловира не установлена.
Редко: ангионевротический отек.
Очень редко: токсический эпидермальный некролиз, мультиформная экссудативная эритема.
Нарушения со стороны почек и мочевыводящих путей
Редко: повышение концентрации мочевины и креатинина в сыворотке крови.
Очень редко: острая почечная недостаточность, почечная колика.
Почечная колика может быть связана с почечной недостаточностью и кристаллурией.
Общие расстройства и нарушения в месте введения
Часто: утомляемость, лихорадка.
Фармакологическое действие
Ацикловир обладает выраженным противовирусным свойством. Применяется для лечения папиллом, бородавок и других инфекционных состояний, возникающих вследствие проникновения в организм опасных болезнетворных возбудителей.
Но стоит понимать, что фармакологическую активность препарат проявляет исключительно при тесном контакте с вирусными клетками. Лекарство воздействует на наследственный аппарат, предупреждая дальнейшее развитие болезни. Выводятся образовавшиеся продукты вместе с мочой.
Действующее вещество Ацикловира характеризуется малой биодоступностью. Поэтому беспрепятственно проникает во все ткани и клеточные структуры, в том числе кровь. Но за счет такого свойства, противовирусный препарат не используется в лечении женщин во время вынашивания ребенка и грудного вскармливания, поскольку главный компонент проникает в грудное молоко.
Передозировка
Ацикловир лишь частично абсорбируется в желудочно-кишечном тракте. Как правило, при случайном однократном приеме ацикловира в дозе до 20 г токсические эффекты не были зарегистрированы. При повторных приемах внутрь в течение нескольких дней доз, превышающих рекомендованные, отмечались нарушения со стороны желудочно-кишечного тракта (тошнота, рвота) и нервной системы (головная боль и спутанность сознания). Иногда могут наблюдаться такие неврологические эффекты, как судорожные припадки, кома.
Пациенты нуждаются в тщательном медицинском наблюдении с целью выявления возможных симптомов интоксикации. Ацикловир выводится из организма с помощью гемодиализа, поэтому гемодиализ может быть использован для лечения передозировки.