Аномалии и патологии полости рта, в особенности зубного ряда – явление, с которым так или иначе неизбежно сталкивается каждый человек. Кариес, воспаление десен, зубная боль – любая болезнь требует помощи специалиста, поскольку мешает нормальной повседневной деятельности. Подавляющее большинство патологий являются следствием неправильного ухода за зубами и полостью рта – регулярно выполняя комплекс оздоровительных процедур, можно предотвратить заболевания и избавить себя от лишних проблем.
Интактный – это какой?
Что такое интактный зуб в стоматологии? В переводе с латинского intactus означает «нетронутый». Соответственно, интактный – это тот, что цел, здоров и не затронут никакими воспалительными процессами и заболеваниями. Услышав этот термин по отношению к своим зубам после профилактического осмотра, пациент должен радоваться. Вдвойне больше положительных эмоций можно испытать, если врач говорит, что у вас интактный зубной ряд, ведь это означает, что все элементы в ряду здоровы.
Важно! Термин может применяться не только в отношении целого зуба, но также и отдельных его составляющих и структур – эмали, коронки, корня, тканей пародонта. Врач может употребить и такое словосочетание, как интактная поверхность, а это уже совсем не означает, что зуб здоров – он может быть поражен кариесом, пульпитом или периодонтитом, но при этом сохраняются не затронутые инфекцией или разрушительным процессом области.
Правила ухода за полостью рта
Профилактика ротовой полости основывается на сочетании гигиенических процедур и регулярной проверке состояния десен и зубной эмали у специалиста. Развитие болезней зубов – продолжительный процесс, отследить который при периодическом посещении врача не составляет труда. Ежеквартальное обследование позволяет выявить отклонения и возможные негативные факторы, устранение которых на ранней стадии обойдется значительно проще и дешевле для пациента.
Чистка зубов и полости рта – ключевая гигиеническая процедура, целью которой является удаление остатков пищи и препятствование образованию зубного налета. Частицы еды, застревающие в труднодоступных местах, становятся благотворной средой для скопления и развития патогенных бактерий, разъедающих эмалевое покрытие зубов, формирующих кариес и провоцирующих воспалительные процессы. Регулярное использование щетки и зубной пасты – общераспространенный и доступный метод, сохраняющий свежесть дыхания и белизну зубов, и предотвращающий наиболее распространенные виды болезней.
Случаи, в которых приходится препарировать интактные поверхности
Установка виниров и люминиров
Врачи обязательно прибегают к препарированию твердых тканей перед установкой протезов. Даже если вы собираетесь поставить просто виниры или ультраниры, чтобы скрыть неудовлетворительный оттенок эмали и диастемы, то нужно быть готовым к обточке. Фронтальную поверхность, даже если она полностью интактная, будут подвергать незначительному препарированию. Сколько тканей придется сточить? Все будет зависеть от толщины накладки, примерно 0,3–0,8 мм.
На заметку! Если вы решили улучшить эстетику зоны улыбки с помощью художественных реставраций композитом, скрыть диастему (межзубную щель) например, то врач также проведет незначительное препарирование фронтальных поверхностей передних единиц, чтобы к ним лучше прилегали пломбировочные материалы.
Меньше всего обтачивать эмаль придется, если вы отдадите предпочтение люминирам. Однако врачу все равно придется ее слегка пришлифовать на толщину, равную толщине накладки (около 0,3 мм), чтобы обеспечить высокое качество фиксации и естественность улыбки.
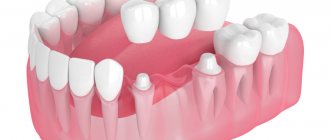
Протезирование мостами
Интактный зуб может выступать в качестве опорного при протезировании мостами. А перед установкой конструкции его придется очень сильно препарировать, будет проведена трепанация (вскрытие) коронки и удаление пульпы.
Лечение пульпита и периодонтита
Врач может затронуть интактную поверхность, например, небную, при лечении пульпита или периодонтита на резцах или клыках для того, чтобы обеспечить доступ к коронковой части пульпы и устьям корневых каналов. Сделать это с фронтальной стороны режущего края не представляется возможным, так как тогда возникает риск испортить природную форму, эстетику и функциональность.
Исправление прикуса
Приходится затрагивать интактные поверхности некоторых зубов при проведении такой процедуры, как сепарация (шлифовка). Чаще всего она применяется в ортодонтии, если патология прикуса незначительная. Процедура помогает избежать удаления некоторых элементов ряда. В процессе врач стачивает эмаль с боковых поверхностей и может высвободить до 5 мм пространства на челюсти.
Меры профилактики
Все всевозможные меры профилактики, помогающие сохранить зубы здоровыми, можно подразделить на 4 группы:
- Регулярное посещение врача.
- Правильная гигиена ротовой полости.
- Контроль питания. Обеспечение организма питательными компонентами, обеспечивающими правильное развитие зубочелюстного аппарата. Прием или, напротив, исключение тех продуктов, которые своей физической формой полезны или вредны для состояния эмали и дентина.
- Улучшение общего состояния здоровья.
Посещение врача с профилактической целью
Как уже отмечалось, стоматолога нужно посещать не реже 2-х раза в год. Оптимальной периодичностью считается 1 раз в 3 месяца. Во время профилактического осмотра врач обязательно заметит начало развития болезни и примет необходимые меры.
Основания к проведению трепанации зуба и ход действий специалиста.
В этой публикации обсудим значимость фотодинамической терапии в стоматологии.
Здесь https://www.vash-dentist.ru/lechenie/zubyi/lidoksor-partner-stomatologa.html все самое важное о препарате Лидоксор.
Уход за ротовой полостью
Чистить зубы нужно не меньше 2-х раз в день: первый – утром после еды (перед завтраком можно прополоскать рот), второй, обязательный – вечером после ужина. Предночная чистка важнее первой, поскольку если ее не делать, в ротовой полости будут длительно находиться остатки пищи.
Для чистки апроксимального пространства нужно использовать ершики и флоссы.
Начинать и заканчивать чистку нужно полосканием рта ополаскивателем или чистой водой.
Щетка меняется один раз в 2-5 месяцев, паста – каждые 1,5-2 месяца. Щетина не должна быть очень жесткой, подходить для эмали и десен, головка щетки – нетравмоопасная. Желательно периодически использовать специализированные пасты с фтором, кальцием, триклозаном, отбеливающие, с лечебными травами.
Для чистки МВП и ортодонтических аппаратов рекомендуется использовать суперфлоссы – более тонкие нити особого строения.
Чистить нужно и язык специальным скребком.
Нельзя использовать для чистки посторонние предметы, например, иголки. Даже зубочистками нужно пользоваться аккуратно, без излишнего усердия, чтобы не повредить эмаль и не травмировать десну.
Питание
Пища должна содержать все необходимые организму компоненты. Слишком сладкие и кислые продукты считаются вредными для эмали и дентина, их прием желательно сократить.
В меню должны присутствовать не только мягкие, но и достаточно твердые продукты, которые частично очищают зубы от мягкого налета и создают для них здоровую нагрузку. В то же время слишком твердые (орехи, сухари) и вязкие (ирис) продукты из рациона нужно исключить.
Общее состояние здоровья
Установлено, что между кариесом и некоторыми заболеваниями и состояниями существуют причинно-следственные связи. Подверженность кариесу увеличивается при болезни Кашина-Бека, гипотиреозе, ревматизме, изменении гормонального статуса.
Предрасполагающим к кариесу фактором является беременность. Очень опасна для состояния эмали и дентина лучевая терапия, применяемая при лечении новообразований головы и шеи.
На восприимчивость человека к кариесу влияет и наследственность.
Точный механизм воздействия общего состояния здоровья на состояние зубов до конца не изучен. Однако предполагается, что связь между ними обуславливается пульпой, в которой находятся кровеносные сосуды, питающие дентин и эмаль, составом ротовой жидкости и состоянием пародонта.
Для всех вышеперечисленных случаев разработаны особые профилактические меры, которые снижают риск и тяжесть опосредствованных зубных заболеваний. Их нужно использовать по рекомендации врача.
О том, как сохранить здоровье зубов, узнайте из видео.
Ортодонтическая коррекция прикуса
Нередки клинические случаи, в которых перед лечением аномалий прикуса брекетами или каппами сначала приходится удалять некоторые зубы. Делается это для высвобождения свободного пространства на челюсти. При этом сам интактный зуб может иметь нормальное расположение, но им приходится жертвовать. Часто удалению подвергаются третьи моляры, реже – вторые и первые.
На заметку! Под определение интактного попадает зуб, не затронутый стоматологическими заболеваниями, такими как кариес, пульпит или периодонтит. Однако при этом он может быть искривлен, занимать неправильное положение в ряду, быть сверхкомплектным, иметь признаки макродентии (слишком крупные по размеру коронки) или микродентии (маленькие коронки).
Если интактная единица сверхкомплекта или у нее слишком большая коронка, то вероятнее всего, перед установкой брекетов ее придется удалить.
Проблемы у детей
У детей иногда возникает необходимость удаления интактных «молочников». Чаще всего это бывает при аномалиях формы и положения (суженной челюсти, например), когда здоровый элемент мешает провести коррекцию. Подлежат удалению дистопированные «молочники».
Удаления интактных единиц может потребовать их шаткость перед биологической сменой прикуса. Наиболее благоприятным временем для этого является прорезывание первого постоянного моляра.
Как и у взрослых, показанием к экстирпации являются кисты и опухоли в альвеолярный области.
Нарушение лицевых пропорций и необходимость их коррекции также может потребовать удаления не затронутой разрушением единицы.
Важно. Удаление здорового молочника должно иметь веские показания, основанные на результатах диагностики, в том числе и рентгенографической.
Отсутствие «молочника» может оказать неблагоприятное воздействие на зачатки и рост постоянных единиц.
Зачем проводить удаление молочных интактных единиц
Сделать это необходимо в тех случаях, когда затянуты сроки смены молочных единиц на постоянные. В возрасте 7–8 лет начинается прорезывание постоянных зубов, а вот временные должны начать выпадать, но не у всех детей этот процесс проходит гладко.
Бывает и так, что молочные в силу излишней минерализации или из-за индивидуальных особенностей организма даже не шатаются, хотя зачатки постоянных уже упираются в их корни.
Если не провести своевременного удаления таких элементов, то постоянные могут пробиться во второй ряд. Это может стать причиной скученности и нарушения прикуса во взрослом возрасте.
Радионуклидная диагностика в онкологии
© ФГОУ «ГЦИПК» — ГУ-МРНЦ РАМН УДК: 616-006-079.8-611.441:615.849
Аналитический обзор
Г.А. Давыдов, к.м.н.
ГУ – Медицинский радиологический научный центр РАМН, Обнинск, ул. Королева 4, 249036 г., Калужская область, Российская Федерация
Адрес для переписки: Герман Анатольевич Давыдов; e-mail:
Ключевые слова:
онкология, диагностика, радионуклиды.
Введение
Ранняя диагностика злокачественных новообразований остается одной из наиболее актуальных задач современной медицины. Возможности методов ядерной медицины в онкологии основаны в первую очередь на выявлении метаболических нарушений в опухолях и окружающих тканях. Принцип функциональной визуализации опухолей отличает методы ядерной медицины от анатомо-топографических методов лучевой диагностики (ультразвуковой томографии, рентгеновской компьютерной томографии и магнитно-резонансной томографии), которые оценивают динамику новообразований по изменению их размеров и структуры. Особенности радионуклидных методов позволяют использовать их для выявления опухолевых поражений в ситуациях, когда структурные изменения не определяются или неспецифичны, а также для оценки раннего ответа опухоли на специфическую терапию, в целях прогнозирования результатов лечения.
Состояние проблемы
Наряду с однофотонной эмиссионной компьютерной томографией (ОФЭКТ), основанной на использовании гамма-излучающих радионуклидов, все большую диагностическую роль в онкологии играет позитронная эмиссионная томография (ПЭТ). Использование в качестве метки биологически важных ультракороткоживущих позитрон-излучающих радионуклидов (11C, 13N, 15O, 18F), позволило создать радиофармпрепараты, обладающие уникальными свойствами (РФП). ПЭТ обеспечивает лучшие возможности для дифференциальной диагностики злокачественных и доброкачественных новообразований, определения распространенности опухолевого процесса, раннего выявления рецидивов и оценки эффективности проводимого лечения.
Основными задачами радионуклидной диагностики при исследовании онкологических больных являются следующие:
- дифференциальная диагностика злокачественных опухолей и доброкачественных новообразований;
- определение распространенности опухолевого процесса (уточнение стадии процесса);
- выявление рецидивов и метастазов после проведенного лечения;
- оценка эффективности противоопухолевой терапии.
РФП для сцинтиграфической диагностики опухолевого процесса
Применяемые для диагностики опухолей РФП разделяют на следующие группы:
- способные накапливаться в тканях, окружающих опухоль (в интактных тканях и тканях, подверженных неспецифическим изменениям со стороны опухоли);
- тропные к мембранам опухолевых клеток (по реакции «антиген-антитело» и по механизму клеточной рецепции);
- проникающие в опухолевые клетки (специфические и неспецифические) [1].
РФП, способные накапливаться в интактных тканях, окружающих опухоль
РФП этой группы отличаются тропностью к той или иной ткани организма, что позволяет выявить наличие опухоли как область пониженного накопления индикатора – «дефект накопления». К ним относятся: 99mТс-коллоид, который аккумулируется в купферовских клетках печени. 99mТс-пертехнетат и изотопы йода (123I или 131I), использующиеся для диагностики опухолей щитовидной железы. Недостатком методик с использованием этих препаратов является невысокая специфичность, так как любое объемное поражение (например, киста) визуализируется аналогичным образом.
РФП, способные накапливаться в тканях, подверженных неспецифическим изменениям со стороны опухоли
Использование РФП данной группы основано на свойстве их повышенного включения в участки ткани, окружающие новообразование. Так, окружающие костную опухоль ткани реагируют на ее рост повышенной остеобластической активностью. Фосфатные комплексы 99mТс, накапливаясь в остеобластах этих участков, позволяют визуализировать костные метастазы и первичные опухоли костей на самой ранней стадии их развития как очаги гиперфиксации РФП. Метод остеосцинтиграфии обладает высокой чувствительностью, однако специфичность его невысока. Высокое накопление указанных РФП в костной ткани может наблюдаться также при травмах, воспалительных и дистрофических заболеваниях.
С целью паллиативной терапии метастазов в кости применяются меченный самарием-153 этилендиаминтетраэтиленфосфонат и меченный рением-186 этидронат, накапливающиеся в участках с повышенной остеобластической активностью.
РФП, тропные к мембранам опухолевых клеток по реакции «антиген-антитело»
В основе диагностического применения РФП данной группы в онкологии лежит реакция связывания меченых моноклональных антител с антигенами мембран раковых клеток. В радионуклидной диагностике нашли применение как целые антитела типа IgG, так и их фрагменты (Fab-fragments of antibody). Для диагностики колоректального рака применяется препарат на основе целых антител – 111In-Онкосцинт, а также фрагментов антител – 99mTc-КЭА-Скан. Преимуществом фрагментов меченых антител является более высокая онкоспецифичность. Однако ускоренный клиренс фрагментов антител из крови за счет более быстрого, по сравнению с большими молекулами иммуноглобулинов, выведения почками может снижать соотношение «опухоль/фон» в злокачественных новообразованиях с обедненным кровотоком. Кроме того, технология получения Fab является достаточно трудоемкой и дорогостоящей.
РФП, тропные к мембранам опухолевых клеток по механизму клеточной рецепции
Применение таких РФП для сцинтиграфической диагностики основано на их тропности к некоторым рецепторам мембран опухолевых клеток.
Из индикаторов такого типа наиболее часто используются аналоги соматостатина – окреотид, меченный 111In, и 99mТс-депреотид (NeoSpect). Соматостатин представляет собой тетрадекапептид, секретируемый гипоталамусом, который подавляет выделение нейроэндокринных гормонов (гормон роста, глюкагон, инсулин и гастрин). Во многих злокачественных опухолях и при некоторых воспалительных заболеваниях плотность рецепторов соматостатина значительно повышается. Гиперэкспрессия рецепторов соматостатина наблюдается в большинстве нейроэндокринных опухолей, включая мелкоклеточный рак легкого, а также в перитуморальных венах некоторых опухолей человека.
Меченые аналоги соматостатина нашли применение для диагностики ряда нейроэндокринных опухолей (карциноид, феохромацитома, параганглиома, меланома), мелкоклеточного рака легких, новообразований центральной нервной системы и лимфом. Чувствительность и специфичность сцинтиграфического выявления таких злокачественных новообразований с применением 111In-окреотида превышает 80%. Вместе с тем, диагностика онкологических поражений печени и селезенки с этим РФП существенно затруднена по причине высокого уровня неспецифической аккумуляции данного индикатора в указанных органах. Депреотид, меченный 99mТс, используется преимущественно для выявления рака легкого. При этом чувствительность диагностики злокачественных солитарных легочных новообразований в комбинации сцинтиграфии с КТ или рентгенографией грудной клетки достигает 97% при специфичности 73% [1].
В последние годы в онкологической практике нашли применение меченные 123I пептиды, которые также способны связываться с мембранами опухолевых клеток. Среди них следует отметить 123I-вазоактивные кишечные пептиды для визуализации злокачественных новообразований желудочно-кишечного тракта и поджелудочной железы; 123I-ά-меланоцитостимулирующий гормон для диагностики меланом; 123I-инсулин, накапливающийся в гепатомах, и 123I-нейропептиды для выявления мелкоклеточного рака легкого.
Специфические РФП, проникающие в опухолевые клетки
Радиофармпрепараты указанной группы включаются в специфический метаболизм опухолей. К ним относятся изотопы йода 123I и 131I, 123I-метайод-бензил-гуанидин (123I-МИБГ) и пятивалентный 99mТс (V)-ДМСА.
Йод-131 уже более 50 лет успешно используется для диагностики метастазов фолликулярного и папиллярного рака щитовидной железы, поскольку дифференцированные опухоли щитовидной железы сохраняют способность захватывать йод и включать его в синтез тиреоидных гормонов. Метастазы раковой опухоли обнаруживаются в виде участков экстратиреоидного эктопического накопления.
В последние годы для выполнения радиодиагностических процедур все чаще вместо 131I используют 123I, который имеет ряд преимуществ: оптимальный для регистрации спектр энергетического излучения (159 кэВ) и короткий период полураспада (13,2 часа), способствующий уменьшению лучевой нагрузки на пациента.
К специфическим опухолетропным препаратам относится также 123I-МИБГ, который через норэпинефриновый механизм поглощения превращается в катехоламины адренергических нервных окончаний и клеток мозгового слоя надпочечников, позволяя тем самым визуализировать надпочечники. Наряду с этим была показана высокая эффективность использования указанного РФП для диагностики и терапии нейроэндокринных опухолей, особенно феохромоцитом, нейробластом, карциноида, медуллярного рака щитовидной железы и параганглиом. Для радиотерапевтических целей используется МИБГ, меченный 131I.
К РФП этой группы также относят пятивалентный 99mТс(V)-ДМСА, специфично накапливающимся в клетках медуллярного рака щитовидной железы. Однако механизм аккумуляции 99mТс(V)-ДМСА в опухоли остается неизученным [1, 7].
Неспецифические РФП, проникающие в опухолевые клетки
Цитрат галлия-67 (67Ga-цитрат) уже много лет успешно используется как туморотропный радиофармпрепарат. 67Ga после внутривенного введения образует комплекс с трансферрином крови, который связывается с рецепторами некоторых опухолевых клеток. Посредством инвагинации целлюлярной мембраны 67Gа-трансферрин попадает внутрь клетки и, образовав комплекс с лактоферрином, остается в ней [1, 7].
67Ga-цитрат хорошо зарекомендовал себя в качестве РФП для радионуклидной диагностики лимфом и мелкоклеточного рака легких. В литературе описаны случаи применения этого РФП и для выявления других злокачественных образований. В то же время, неспецифическая аккумуляция 67Ga-цитрата в печени и экскреция в желудочно-кишечный тракт ограничивают его использование для диагностики опухолей брюшной полости. Специфичность метода снижает также аккумуляция 67Ga-цитрат в зонах инфекции и воспаления. Сцинтиграфия с этим РФП особенно эффективна для динамического наблюдения за больными с верифицированными злокачественными новообразованиями в динамике химио- или лучевой терапии.
Изотопы таллия (201Тl и 199Тl), являясь биологическим аналогом калия, поступают внутрь клетки с помощью натрий-калиевого АТФ-зависимого насоса и локализуются в митохондриях. Эти РФП аккумулируются преимущественно в тканях с интенсивным энергетическим обменом (к числу которых относятся атипичные клетки) и широко используются для диагностики самых разнообразных опухолей, включая новообразования бронхов, лимфомы, рак щитовидной железы, костей и головного мозга. Как и цитрат 67Ga, изотопы таллия успешно применяют для динамической оценки противоопухолевой терапии.
В последнее время в ядерной онкологии стали активно использоваться комплексы технеция-99m с метокси-изобутил-изонитрилом (99mТс-МИБИ) и тетрофосмином (миовью), благодаря способности этих РФП к усиленной аккумуляции в митохондриях злокачественных клеток. Наиболее активно эти индикаторы используют для выявления рака молочной железы, опухолей легких, лимфом и миеломной болезни [1, 7].
РФП для позитронно-эмиссионной томографии
Позитронно-излучающий РФП 18F-фтордезоксиглюкоза (18F-ФДГ) позволяет с высокой чувствительностью выявлять самые разнообразные злокачественные новообразования.
Аккумуляция этого индикатора в клетке прямо пропорциональна эффективности функционирования белкового переносчика глюкозы и коррелирует с активностью гексокиназы II – фермента, реализующего обмен гидроксильной группы глюкозы на фосфатный комплекс АТФ. Фосфорилированный метаболит 18F-фтордезоксиглюкозы теряет способность к транспорту через мембрану клетки и остается интрацеллюлярно. Таким образом, ФДГ в отличие от обычной глюкозы, попадая внутрь клетки, участвует только в начальных этапах гликолиза, поэтому не распадается, за счет чего и происходит ее прогрессивное накопление в клетке (феномен «метаболической ловушки»). Высокое соотношение кон достигается, таким образом, за счет заметно более высокой активности гексокиназы II в малигнизированных клетках. Визуализация опухолей осуществляется за счет повышенной гликолитической активности клеток опухолевой ткани и повышенной активности глюкозных транспортеров на мембранах опухолевых клеток, осуществляющих захват глюкозы внутрь клетки. При этом биологическая активность опухоли прямо пропорциональна степени метаболического захвата глюкозы [2-4].
Применение другого неспецифического позитронно-излучающего РФП 11С-метионина для диагностики опухолей базируется на высоком уровне аминокислотного обмена в активно пролиферирующих клетках злокачественных опухолей. Этот индикатор используется при выявлении лимфом, злокачественных новообразований шеи и головы.
Для диагностики новообразований методом ПЭТ применяется ряд туморотропных РФП, визуализирующих злокачественные опухоли как очаги нарушения метаболизма. Для изучения нарушений углеводного обмена (клеточная энергетика) применяется 18F-фтордеоксиглюкоза (18F-ФДГ); клеточного транспорта аминокислот – 11С-метионин; процессов клеточного синтеза белков – 11С-тирозин, 11С-лейцин; скорости клеточной пролиферации – 11С-тимидин (как маркер синтеза ДНК) и 11С-холин (участвующий в биосинтезе клеточной мембраны); синтеза липидов – (11С-ацетат); степени гипоксии опухолевой ткани – 18F-фтормизонидазол [4].
Индикаторы гипоксии являются перспективными РФП для сцинтиграфической диагностики злокачественных новообразований. Визуализация малигнизированных тканей в этом случае становится возможной потому, что в центральных областях опухоли имеют место обеднение кровотока и сопутствующая гипоксия. Нитроимидазол путем диффузии проникает внутрь клетки за счет липофильности своей молекулы, образуя в условиях гипоксии ряд недоокисленных продуктов своего превращения. Эти метаболиты связываются с компонентами клетки и, в отличие от нормы, фиксируются интрацеллюлярно [2, 8].
КЛИНИЧЕСКОЕ ПРИМЕНЕНИЕ ПЭТ В ОНКОЛОГИИ
ПЭТ в настоящее время нашла широкое применение во многих областях медицины. Первый опыт использования этого метода был посвящен функциональным исследованиям головного мозга. В дальнейшем ПЭТ стала успешно использоваться для диагностики различных форм деменции, очаговых форм эпилепсии.
В кардиологии ПЭТ-исследования сердца дают уникальную информацию о жизнеспособности миокарда, таким образом определяя целесообразность кардиохирургических вмешательств. Однако самым востребованным метод ПЭТ оказался в онкологии. Этому способствовало появление и начало серийного изготовления установок для ПЭТ «всего тела», а также разработка большого ассортимента позитронно-излучающих туморотропных РФП. Ценнейшая информация, получаемая при исследованиях больных злокачественными новообразованиями, сделала ПЭТ одним из ведущих диагностических методов. Это обстоятельство привело к резкому возрастанию относительной доли онкологических ПЭТ-исследований, которая в настоящее время составляет около 90%.
Самой распространенной и наиболее освоенной методикой является ПЭТ с 18F-фтордеоксиглюкозой (18F-ФДГ). Количество этих исследований приобрело такой размах, что, по мнению ведущих специалистов ядерной медицины, 18F-ФДГ завоевала в 1990-х гг. номинацию «молекулы века» [4, 6].
Применение ПЭТ в диагностике рака легких
ПЭТ c ФДГ высоко эффективна в дифференциальной диагностике первичных опухолей у больных с солитарными легочными узлами: прогностическая ценность положительного результата – 90%, отрицательного результата – до 100%.
Ложноотрицательный результат может наблюдаться при поражениях менее 1 см, опухолях с низкой метаболической активностью (например, карциноидных), бронхоальвеолярном раке. Повышенное включение ФДГ возможно при различных воспалительных заболеваниях. В сомнительных случаях поражения с повышенным захватом ФДГ должны считаться злокачественными, пока не будет доказано обратное.
Оценка региональных лимфоузлов средостения у потенциально операбельных больных немелкоклеточным раком легкого превышает результаты КТ и составляет: чувствительность 89%, специфичность 92% и точность 90%. Лучшие результаты ПЭТ объясняются тем, что размеры лимфоузлов являются относительным критерием метастатического поражения. Лимфоузлы могут быть увеличены вследствие воспаления или инфекции, а мелкие узлы могут содержать метастазы.
При выявлении внутригрудных метастазов ПЭТ несколько точнее КТ. По сравнению со стандартной остеосцинтиграфией с 99mTc-метилендифосфонатом, ПЭТ имеет большую специфичность (98% против 61%) при аналогичной чувствительности (до 90%) при визуализации метастазов в кости. Интерпретация сцинтиграфии костей с МДФ затруднена из-за ложноположительных результатов при воспалительных и дистрофических изменениях костей и суставов.
Отмечается высокая эффективность ФДГ-ПЭТ в выявлении рецидивов немелкоклеточного рака легкого. При подозрении КТ на рецидив ПЭТ способна дифференцировать посттерапевтические рубцы и опухоли с чувствительностью 97-100%, специфичностью 62-100% и точностью 78-98% (Рис.1). Чтобы избежать ложноположительных результатов ПЭТ вследствие лучевого пневмонита или гликолиза макрофагов внутри опухолевого некроза, исследование рекомендуется проводить через 4-6 месяцев по окончании лечения.
Показаниями к проведению ПЭТ с ФДГ у больных немелкоклеточным раком легкого являются: дифференциальная диагностика первичной опухоли, определение распространенности опухолевого процесса, выявление рецидивов.
Рис. 1
. Результат ПЭТ-исследования. Выявление рецидивной опухоли верхушки левого легкого.
Применение ПЭТ в диагностике рака толстой кишки
Основными задачами ПЭТ с ФДГ при исследовании больных раком толстой кишки являются:
- рецидивов и отдаленных метастазов у больных с повышенным уровнем опухолевых маркеров после операции;
- дифференциальная диагностика между рецидивом опухоли и исключение отдаленных метастазов при оценке распространенности опухолевого процесса до операции и повторных резекций;
- выявление послеоперационной рубцовой тканью.
Метод ПЭТ недостаточно эффективен при диагностике регионарных лимфоузлов. Причина низкой чувствительности объясняется расположением большинства лимфоузлов вблизи первичной опухоли или наличием в них микрометастазов. Однако отсутствие вовлечения лимфоузлов не вызывает изменения в лечении, поскольку удаление брыжейки без первичного поражения является частью лечебной процедуры. ПЭТ является наиболее чувствительным (90-95%) методом выявления метастазов в печень колоректального рака, в чем превосходит КТ, при специфичности 88-100%. Исключение отдаленных метастазов до операции и повторных резекциях является важным показанием ФДГ-ПЭТ у больных колоректальным раком.
Показаниями к ПЭТ у больных с выявленным или подозреваемым рецидивом являются: увеличение опухолевых маркеров, аномальное поражение при стандартной визуализации (КТ и МРТ), дифференциальная диагностика местных рецидивов и посттерапевтических (хирургических, лучевых и химиотерапевтических) изменений. ПЭТ позволяет дифференцировать рецидив опухоли от захвата ФДГ вследствие лучевой терапии (спустя 6 месяцев после лечения). По данным ПЭТ выявляется больше поражений, чем при КТ, что приводит к серьезным изменениям в лечении у 48% больных.
Примером успешной дифференциальной диагностики между рецидивом опухоли и послеоперационной рубцовой тканью является выявление, по данным ПЭТ, рецидива рака прямой кишки после брюшно-промежностной экстирпации прямой кишки, когда эндоскопия оказалась невозможной, а УЗИ и КТ не позволяли дифференцировать рецидив и послеоперационные рубцовые изменения (Рис.2).
Рис. 2
. ПЭТ с 18F-ФДГ. Визуализация рецидива рака прямой кишки (а) на фоне физиологического накопления радиофармпрепарата в головном мозге и почках.
Применение ПЭТ в диагностике гемобластозов
При исследовании больных злокачественными лимфомами перед ФДГ-ПЭТ ставятся задачи по определению стадии опухолевого процесса, оценке эффективности лечения, выявлению рецидивов заболевания. Диагностическое обследование больных злокачественными лимфомами является одним из наиболее значимых показаний для проведения ПЭТ с ФДГ.
При стадировании злокачественной лимфомы ФДГ-ПЭТ имеет одинаковую специфичность с РКТ (90%), однако превосходит ее в чувствительности (92% и 65% соответственно). Точность оценки состояния селезенки при первичном стадировании злокачественной лимфомы для ФДГ-ПЭТ составляет около 100% (для КТ –57%), а точность диагностики поражения костного мозга посредством ФДГ-ПЭТ сопоставима с таковой при биопсии костного мозга.
ПЭТ с ФДГ успешно применяется для оценки эффективности проводимого лечения. Контроль ответа на химиотерапию обычно проводится через 3-4 цикла лечения. По данным некоторых исследователей, прогностическая информация может быть получена уже после первого цикла химиотерапии (Рис.3).
Рис. 3
. ПЭТ-исследование при злокачественной лимфоме: а) до лечения (поражение правых шейно-надключичных и медиастинальных лимфоузлов); б) после эффективного лечения (отсутствие активных очагов специфической ткани).
Применение ПЭТ в диагностике метастазов меланомы
Меланома относится к опухолям с наиболее выраженным гликолизом, высоким захватом ФДГ и соотношением «опухоль-кровь». Основными задачами ПЭТ с ФДГ при обследовании больных меланомой являются: диагностика местной и региональной распространенности опухолевого процесса у больных меланомой высокого риска (толщина первичной опухоли больше 4,0 мм с прорастанием в подкожные ткани), выявление отдаленных метастазов и рецидивов опухоли.
В диагностике первичной опухоли и пораженных регионарных лимфоузлов в стадиях 1-2 метод ПЭТ с ФДГ обладает низкой чувствительностью, большая по величине опухоль выявляется отчетливо. В стадии 3 визуализируются практически все метастазы в регионарные лимфоузлы размерами более 10 мм, 83% метастазов размерами 6-10 мм и 13% метастазов меньших размеров.
В диагностике метастазов во внутренние органы общая чувствительность ПЭТ с ФДГ составляет 80-100%. Наиболее полезна ПЭТ у больных с наличием метастазов в брюшной полости (чувствительность – до 100%). По сравнению со стандартной КТ, ПЭТ более чувствительна и специфична в визуализации метастазов в кости, тонкую кишку и лимфоузлы, в то время как метастазы в легкие выявляются хуже. В диагностике метастазов в печень ПЭТ более чувствительна, чем УЗИ, КТ и МРТ.
Применение ПЭТ в диагностике распространенности рака пищевода и желудка
Основными задачами исследования ПЭТ с ФДГ у больных раком пищевода и желудка являются: стадирование лимфоузлов и выявление отдаленных метастазов у больных с резектабельной опухолью.
Первичные опухоли пищевода и желудка, ограниченные слизистой оболочкой, с помощью ФДГ-ПЭТ визуализируются плохо. Их выявление становится возможным только при инвазии опухоли в подслизистый слой. Специфичность ПЭТ в стадировании лимфоузлов выше, чем у других методов лучевой диагностики (КТ, эндоскопической сонографии). В оценке отдаленных метастазов (в лимфоузлах, печени, плевре, грудной клетке и костях) ПЭТ с ФДГ имеет большую точность по сравнению со стандартным использованием СКТ и УЗИ. ПЭТ обладает высокой диагностической эффективностью в выявлении рецидивов рака пищевода, однако в диагностике перианастомотических рецидивов часто дает ложноположительные результаты из-за накопления ФДГ в участках воспаления. Отмечается высокая эффективность ПЭТ с ФДГ в оценке ответа на лучевую и химиотерапию опухолей пищевода и желудка.
Применение ПЭТ в диагностике распространенности опухолей головы и шеи
Эффективность лечения больных раком органов головы и шеи в существенной мере зависит от точности оценки местной и регионарной распространенности опухолевого процесса.
Первичные опухоли, региональные и отдаленные метастазы характеризуются интенсивным захватом ФДГ. Метастазы в лимфоузлы характеризуются высоким захватом ФДГ и хорошо контрастируются. Установлено, что в выявлении метастатического поражения шейных лимфатических узлов у больных раком органов головы и шеи чувствительность и специфичность ПЭТ с ФДГ составили 90 и 94%, в то время как аналогичные показатели для КТ были 82 и 85%, МРТ – 80 и 79%.
ПЭТ с ФДГ также является эффективным и объективным инструментом оценки эффективности химиотерапии и лучевого лечения злокачественных опухолей головы и шеи. Метод позволяет дифференцировать жизнеспособную опухолевую ткань от фиброзно-склеротического процесса после лучевой терапии (Рис.4).
Рис. 4
. ФДГ-ПЭТ и МРТ при плоскоклеточном раке слизистой левой щеки: А, B – до лечения; С, Д – после химиорадиотерапии. При ФДГ-ПЭТ констатирован полный эффект в виде исчезновения гиперметаболического очага (истинно отрицательный результат), хотя на МРТ визуализируется остаточный субстрат (ложноположительный результат).
ФДГ позволяет эффективно выявить пораженные ЛУ средостения, а также отдаленные метастазы в легкие, печень, кости. Отсутствие захвата ФДГ обычно исключает остаточную или рецидивную опухоль.
При обследовании больных дифференцированным раком щитовидной железы наиболее важной задачей ФДГ-ПЭТ является выявление рецидивов у больных с повышенным уровнем опухолевого маркера (тиреоглобулина) на фоне отрицательного скана «всего тела» с 131I. По мнению большинства исследователей, ФДГ-ПЭТ является эффективным методом выявления йод-негативного метастатического поражения шейно-надключичных, медиастинальных лимфоузлов и легких.
Применение ПЭТ в диагностике распространенности рака молочной железы
Основной задачей ФДГ-ПЭТ при исследовании больных раком молочной железы является прогностическая оценка биологической активности первичной опухоли, диагностика регионарных и отдаленных метастазов, оценка эффективности проводимого противоопухолевого лечения и выявление местных рецидивов заболевания. Некоторые исследователи при наблюдении за группой больных местно-распространенным раком молочной железы отметили, что при высокой метаболической активности первичной опухоли, определяемой ФДГ-ПЭТ, можно прогнозировать низкую эффективность неоадъювантной химиотерапии. Что касается предоперационного стадирования рака молочной железы, то, по данным ряда зарубежных авторов, чувствительность ФДГ-ПЭТ при диагностике мультифокального поражения оказалась вдвое выше, чем при комбинированном применении маммографии и ультразвукового метода (63 и 32% соответственно). Чувствительность и специфичность ФДГ-ПЭТ при диагностике метастатического поражения аксиллярных лимфатических узлов составили 79 и 92% соответственно.
Влияние результатов ФДГ-ПЭТ на установление стадии заболевания и выбор тактики лечения рака молочной железы проанализировано в ряде зарубежных работ. Авторы указывают, что с учетом находок ФДГ-ПЭТ клиническая стадия была изменена в 36% наблюдений (28% – в сторону увеличения, 8% – в сторону уменьшения), вид лечения был скорректирован у 28%, а объем лечения – у 30% больных. Диагностическая чувствительность и специфичность ФДГ-ПЭТ при обследовании пациентов с подозрением на рецидив рака молочной железы, имеющих асимптоматическое повышение уровня опухолевых маркеров, составляют 96 и 90% соответственно [2, 4, 5].
Совмещенная ПЭТ/КТ-технология
Позитронные томографы обладают сравнительно невысоким пространственным разрешением, что затрудняет визуальный анализ ПЭТ-изображений. В связи с этим ПЭТ-сканеры производятся в конфигурации со сканерами рентгеновской компьютерной томографии (КТ), совмещенными в одной установке. Совмещение метаболических (ПЭТ) и анатомо-топографических (КТ) данных позволяет повысить точность локализации опухоли и определения распространенности заболевания. Совмещенная ПЭТ/КТ-технология позволяет получать более информативные изображения по сравнению с изображениями, получаемыми КТ- и ПЭТ-методами (Рис.5).
Рис. 5
. КТ-изображение (А) и ПЭТ-изображение (В) плоскоклеточного рака левого легкого с метастазами в лимфоузлы средостения. Совмещенное КТ-ПЭТ-изображение (С) позволяет констатировать в рентгенологически выявленном очаге в легком наличие активной опухолевой ткани по периферии образования и очаг некроза в центре опухоли (помечено стрелкой).
Проблемы применения ПЭТ c ФДГ в онкологии
Клиническое применение ПЭТ с ФДГ выявило ряд ограничений, обусловленных, в частности, неспособностью эффективно выявлять опухоли малых размеров (до 10 мм), визуализировать некоторые опухоли мозга и опухоли мочеполовой системы, а также неспособностью дифференцировать злокачественные заболевания от воспалительных изменений. Поэтому задача разработки новых альтернативных ФДГ радиофармпрепаратов с более высокой туморотропностью и специфичностью является актуальной.
Литература
- Радионуклидная диагностика для практических врачей / Под ред. Ю.Б. Лишманова, В.И. Чернова. Томск: STT, 2004. 394 с.
- Совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) в онкологии /Труфанов Г.Е., Рязанов В.В., Дергунова Н.И. и др. СПб.: ЭЛБИ-СПб, 2005. 124 с.
- Труфанов Г.Е., Рамешвили Т.Е., Дергунова Н.И., Бойков И.В. Совмещенная позитронно-эмиссионная и компьютерная томография (ПЭТ-КТ) в диагностике опухолей головного мозга. СПб.: ЭЛБИ-СПб, 2005. 94 с.
- Ширяев С.В. Опыт применения и перспективы позитронной эмиссионной томографии в онкологии // Лучевая диагностика и интервенционная радиология в клинической онкологии. Европейская школа по онкологии (ГУ РОНЦ, Москва, 16-17 мая 2006 г.). Москва, 2006. С.24-34.
- Eubank W.B., Mankoff D.A. Current and future uses of positron emission tomography in breast cancer imaging //Semin. Nucl. Mec. 2004. Vol.34. P.224-240.
- Ganatra R.D. The Future of Nuclear Medicine //World Journal of Nuclear Medicine. 2002. Vol.1. P.86-88.
- Pauwels E., McCready V., Stoot J., van Deuzen D. The mechanism of accumulation of tumour-localising radiopharmaceuticals //Eur. J. Nucl. Med. 1998. Vol.25. P.277-305.
- Rigo P., Paulus P., Kaschten B.J. et al. // Oncological applications of positron emission tomography with fluorine-18 fluorodeoxyglucose //Eur. J. Nucl. Med. 1996. Vol.23. P.1641-1674.