Невролог (алголог)
Василенко
Марина Геннадьевна
Стаж 25 лет
Руководитель Центра лечения боли, врач-невролог-алголог , член общества неврологов и нейрохирургов, Российского общества по изучению боли, Ассоциации междисциплинарной медицины, International Association for the Study of Pain (IASP)
Записаться на прием
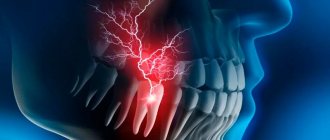
Тройничный нерв – это самый крупный из 12 черепных нервов, в частности, их пятая пара. Он относится к нервам смешанного типа, включает очень чувствительные волокна. Подобное название обусловлено тем, что нерв делится на три ветви, обеспечивающие подвижность и чувствительность лица, слизистых рта и зубов. Это глазная, верхне- и нижнечелюстная ветви.
Воспаление тройничного нерва – серьезная патология, вызывающая сильные боли в области лица. Иначе она называется невритом. В свою очередь, невралгия – это боль по ходу тройничного нерва. Она может выступать как самостоятельное нарушение чувствительности, но часто сопровождает именно воспаление, т.е. неврит.
Симптомы и признаки
Острая невралгия тройничного нерва вызывает внезапную и очень сильную боль по ходу нервного волокна. Она проявляется приступами, носит простреливающий и жгучий характер. В среднем длительность приступа составляет до 3 минут, примерно у 7% пациентов она длится до 3 дней. За сутки их число может достигать 200.
Боль при невралгии тройничного нерва может наблюдаться в разных частях лица. Все зависит от того, какая ветвь нерва была поражена:
- если верхнечелюстная – в области лицевых мышц, верхней челюсти и носа.
- нижнечелюстная – боль будет напоминать зубную.
- глазная – в области висков, лба и над бровями.
На фоне боли у пациента развивается повышенная тревожность и даже фобии. Человек стремится избегать тех поз и движений, которые провоцируют у него неприятные ощущения. Другие характерные симптомы воспаления тройничного нерва:
- спазмы лицевых мышц;
- усиленное слюнотечение;
- повышенная или сниженная чувствительность кожи лица;
- умеренное повышение температуры;
- слабость и боль в мышцах.
У вас появились симптомы невралгии тройничного нерва?
Точно диагностировать заболевание может только врач. Не откладывайте консультацию — позвоните по телефону
Лечение при воспалении лицевого нерва
Медикаментозное лечение
Лечение неврита тройничного нерва носит комплексный характер. Заболевание сначала лечат медикаментозно – пациенту прописывают препараты, которые облегчат ситуацию. К ним относятся обезболивающие, противоотечные, сосудорасширяющие препараты и витамины группы «В». Чаще всего рекомендованные медикаменты – это таблетки, но можно ускорить процесс восстановления за счет применения мазей и гелей. Иногда врачи прописывают назначение на внутримышечные инъекции.
В особых случаях процесс восстановления лицевого нерва может быть замедлен. Тогда пациенту назначают глюкокортикостероиды, которые улучшают обменные процессы нервной ткани. Также скорейшему выздоровлению способствуют различные биостимуляторы и гиалуронидаз.
Нельзя назначать себе препараты самостоятельно. Обязательно при первых симптомах стоит показаться неврологу или невропатологу для определения диагноза и стратегии лечения. Препараты для восстановления рекомендуются пациентам в каждом конкретном случае, обращая внимание на наличие хронических заболеваний, особенности симптомов и так далее.
Хирургическое лечение
Еще один способ лечения лицевого нерва – хирургическое вмешательство. Однако к этому варианту врачи обращаются довольно редко – только при разрыве тройничного нерва. Также операция требуется в случае отсутствия эффекта от консервативного метода спустя полгода-год. Хирургическое вмешательство актуально только в течение первого года наличия заболевания, позднее мышцы на лице необратимо атрофируются.
Процесс операции – специалисты сшивают поврежденный участок лицевого нерва для восстановления его двигательной функции.
Массаж
Следующий метод лечения – массаж при лечении лицевого нерва. Цель такого способа – убрать отек, улучшить кровообращение, восстановить чувствительность и проведение нервных импульсов. Массаж противопоказан при туберкулезе, онкологии, атеросклерозе и повышенной температуре.
Изначально массажист работает только со здоровой стороной лица, воротниковой зоной, шеей и областью над плечами. В основном мастер использует растирание, поглаживание, разминание и вибрацию.
Для заметных желаемых изменений необходимо провести десять-двадцать сеансов массажа от пяти до пятнадцати минут. Длительность определяется исходя из степени воспаления тройничного нерва, задач терапии и динамики восстановления.
Физиотерапия
Следующий метод лечения – это физиотерапия. Она облегчает тяжесть симптомов, помогает активизировать обменные процессы в тканях и восстановить функции лицевого нерва.
Врачи назначают такой курс лечения с первых дней появления неврита. В список физиопроцедур входят:
- Ультразвук
- Лазерное облучение крови
- Электрофорез лекарств
- Микроволновая терапия
- Воздействие электричеством ультравысокой частоты
- Озокеритолечение
- Миоэлектростимуляция
- Дарсонвализация
Такой комплекс показан на первую неделю лечения. Врачи назначают его совместно с медикаментозным. Такой тандем помогает ускорить процесс восстановления лицевого нерва. А самые главные его преимущества – отсутствие побочных эффектов и безболезненность.
Альтернативные методы
Существуют и альтернативные методы лечения. Это процедуры, нацеленные на восстановление мимических мышц и устранение симптомов неврита лицевого нерва. К таким процедурам относят:
- Маски из глины или парафина
- Иглоукалывание
- Рефлексотерапия
- Уколы для устранения мышечных нарушений
- Лечебные ванные
- Тейпирование – натяжение лица при помощи лейкопластырей
- Иммуносорбация – очистка крови от антигенов и антител
- Биоуправление – тренировка мышц лица
Гимнастика для лица
Также в совокупности с комплексным лечением можно делать гимнастику для лица. Перед этим необходимо проконсультироваться со специалистом, врач составит индивидуальный список упражнений, исходя из остроты процесса, места поражения и симптомов. Обычно такая гимнастика занимает около десяти минут в день.
Стандартный комплекс упражнений включает в себя расслабление и напряжение отдельных мышц лица. Например, для восстановления артикуляции рекомендовано произносить звуки «у», «о», «и». После необходимо подвести нижнюю губу под верхние зубы и воспроизводить звуки «в» и «а».
Гимнастика при воспалении тройничного нерва:
- Закрыть глаза
- Поднять брови вверх
- Нахмуриться
- Прищуриться
- Улыбнуться с закрытым ртом
- Улыбнуться с открытым ртом
- Надуть щеки
- Втянуть их обратно
- Посвистеть
- Расширить ноздри
- Свернуть губы трубочкой
- Поднять верхнюю губу и вернуться в исходное положение
- Опустить нижнюю губу и вернуться в исходное положение
- Набрать в рот воды
- Прополоскать ротовую полость
- Закрыть рот
- Водить кончиком языка по деснам
- Двигать языком вправо и влево
Причины возникновения и факторы риска
Невралгия ветви тройничного нерва – заболевание с множеством возможных причин развития. В первую очередь это сдавливание сосудами: смещенными артериями или венами. Также воспаление могут провоцировать нарушения обмена веществ и заболевания, которые с ними связаны. Это сахарный диабет, подагра и прочие подобные патологии.
Существуют и другие возможные причины невралгии тройничного нерва:
- воспаления, возникшие при лечении зубов;
- переохлаждение (общее или лицевой области);
- психические нарушения;
- гнойные заболевания костей челюстей или черепа;
- заражение организма глистами;
- хронический кариес или синусит;
- инфекционные и вирусные заболевания (герпес, аденовирусы, эпидемический паротит, туберкулез легких, опоясывающий лишай);
- очень сильная аллергия;
- опухоли головного мозга;
- воспаления наружного, среднего или внутреннего уха;
- рассеянный склероз;
- слишком узкий канал лицевого нерва от рождения;
- травмы или операции на височной кости.
Возможные осложнения
С течением времени симптомы воспаления тройничного нерва могут дать невропатические осложнения и привести к развитию вторичного болевого синдрома в голове. При хронической форме заболевания раздражаются слуховой и лицевой нервы. Без лечения невралгия тройничного нерва может приводить к более серьезным осложнениям:
- дистрофия жевательных мышц;
- снижение чувствительности пораженной области;
- сикинезия (содружественные движения, при которых один нерв управляет многими мышцами);
- контрактуре и самопроизвольному сокращению лицевых мышц;
- конъюнктивиту.
Сравнительный анализ эффективности комплексной фармакотерапии боли при невралгии тройничного нерва
Боли в области лица могут быть вызваны поражением нервного аппарата челюстно-лицевой области (системы тройничного, языкоглоточного нервов, вегетативных узлов и сплетений) или мышечно-суставной дисфункцией при артрозоартрите височно-нижнечелюстного сустава и нарушении соотношения зубных рядов. Кроме того, описаны рино- и офтальмогенные прозопалгии, патогенез которых сложен, однако в конечном итоге реализуется через неврогенные и мышечные механизмы.
В клинической практике среди краниальных невралгий наиболее часто встречается тригеминальная невралгия, или невралгия тройничного нерва (НТН). Распространенность НТН – 45–50 на 100 тыс. населения с пиком заболеваемости на 6-м десятилетии жизни. Патогенез заболевания сложен. Доказано, что пусковым моментом является корешково-сосудистый конфликт в области мостомозжечкового угла, приводящий к сегментарной демиелинизации корешка тройничного нерва. Сочетание демиелинизации корешка с функциональной и/или структурной дефектностью антиноцицептивных регуляторных систем у данного индивидуума может способствовать формированию так называемого «генератора патологической активности» в системе тройничного нерва и служить основой развития клинической картины НТН [5].
Клиническая картина невралгии тройничного нерва
Больные предъявляют жалобы на пароксизмальную боль, сравнимую с ударом электрического тока. Продолжительность болевого пароксизма не превышает 2 мин., хотя больные могут жаловаться на непрерывную боль. Однако при внимательном расспросе удается установить наличие «светлого» безболевого промежутка между приступами.
Характеристика болевого пароксизма:
1. Боль чрезвычайно сильная и при определении ее интенсивности по 10-балльной шкале боли соответствует 8–10 баллам.
2. Рисунок боли в период обострения не изменяется (боль не может перемещаться на противоположную сторону) и соответствует корешково-сегментарной зоне иннервации.
3. Между двумя отдельными приступами всегда имеется безболевой (рефрактерный) период.
4. Наличие триггерных зон – гиперсенситивных участков на коже лица или в полости рта, слабое раздражение которых вызывает типичный болевой приступ. Триггерные зоны наиболее часто локализуются в медиальных отделах лица или на альвеолярных отростках челюстей.
5. Наличие триггерных факторов – действий или условий, при которых возникают типичные болевые пароксизмы. Наиболее часто такими факторами являются: умывание, прием пищи, движения нижней челюсти.
6. Типичное болевое поведение – во время приступа больные «замирают» в той позе, в которой их застал приступ.
7. На высоте приступа могут быть подергивания лицевой мускулатуры.
8. Отсутствие сенсорного дефекта на лице в дебюте заболевания.
При клинико-неврологическом обследовании на стороне боли может быть отмечено снижение вибрационной чувствительности и корнеального рефлекса. Также во время обострения НТН при наличии активных триггерных зон положителен симптом Штернберга – указывая локализацию триггерной зоны, больной не касается лица из-за боязни вызвать приступ.
Течение заболевания хроническое. У 2/3 больных в дебюте отмечаются легкие пароксизмы боли в проекции зубов, что может быть поводом для их удаления, у 1/3 уже в начале заболевания развиваются пароксизмы интенсивной боли, которые продолжаются 2–3 нед. и проходят самостоятельно. Как правило, через полгода или год приступы возобновляются в более тяжелой форме. В развернутой стадии заболевания обострения (периоды интенсивной боли), развивающиеся чаще в холодное время года, продолжаются 4–8 нед., затем стихают, но без адекватного лечения полностью не проходят. В начале заболевания ремиссии (период стихания болей) могут быть спонтанными, однако, как показывает наш клинический опыт, с течением времени их удается достичь только при адекватной терапии.
По мере развития заболевания, вероятно в связи с нарастанием демиелинизирующего процесса в области корешка тройничного нерва, формируется невропатическая стадия невралгии, когда в клинической картине, наряду с пароксизмами боли, отмечается незначительная постоянная боль. В этой стадии при клинико-неврологическом обследовании выявляется постоянный или преходящий сенсорный дефект периферического типа в зоне иннервации второй и/или третьей ветвей тройничного нерва.
Диагностика типичной НТН не представляет значительных трудностей, однако следует помнить, что пароксизмальная прозопалгия может быть симптоматической, т. е. обусловленной патологическими процессами в области мостомозжечкового угла (опухоль вестибуло-кохлеарного нерва, слипчивый оболочечный процесс и др.). В этой связи больные с впервые выявленной НТН в возрасте до 50 лет, а также с наличием в неврологическом статусе симптомов очагового поражения нервной системы нуждаются в МРТ-обследовании головного мозга.
Лечение невралгии тройничного нерва
Лечение боли при НТН до настоящего времени представляет сложную задачу. В 1962 г. С. Блюм предложил лечить невралгию тройничного нерва карбамазепином. В настоящее время, наряду с карбамазепином, применяются и другие противоэпилептические препараты: габапентин, окскарбазепин, прегабалин (Лирика).
Лечение карбамазепином рекомендуется начинать с 50 мг (1/4 стандартной таблетки, содержащей 200 мг карбамазепина) 3 р./сут во время или после еды, запивая достаточным количеством жидкости [3]. Повышать дозу карбамазепина при хорошей переносимости можно на 50 мг ежедневно. Средняя эффективная доза составляет 600–800 мг/сут. Доза считается эффективной, если болевой синдром купирован полностью (раздражение триггерных зон и триггерные факторы не вызывают болевого пароксизма – больной может принимать пищу и безболезненно выполнять гигиенические процедуры умывания и чистки зубов).
Дальнейшее лечение в течение 3–4 нед. проводится с применением индивидуальной эффективной дозы препарата, что позволяет достичь медикаментозной ремиссии. Затем проводится обратное титрование со снижением суточной дозы на 50 мг в течение 5–7 дней. Целью обратного титрования является достижение индивидуальной поддерживающей дозы, которая может составлять от 100 до 400 мг/сут. В дебюте заболевания у части больных (40–60%) удается полностью отменить препарат. Возможно применение пролонгированных фармакологических форм карбамазепина, которые особенно удобны для проведения поддерживающей терапии.
При лечении препаратами карбамазепина следует помнить, что длительное применение больших доз может привести к развитию побочных явлений в виде головокружения, тошноты, атаксии. Описаны случаи апластической анемии. Поэтому, наряду с клиническим контролем развития возможных побочных эффектов препарата, необходимо следить за состоянием периферической крови и печени (общий анализ крови и содержание АСТ и АЛТ каждые 3 мес.).
Примерно у 15% больных карбамазепин неэффективен. Таким больным подбирают противоэпилептические препараты других групп.
В настоящее время сформулированы основные принципы рациональной полифармакотерапии, предполагающие воздействие на основные патогенетические механизмы нейропатической боли при НТН: периферическую и центральную сенситизацию с одновременной активизацией антиноцицептивной системы [5]. В схемах лечения нейропатической боли применяются местные анестетики, блокирующие проведение болевых импульсов на периферическом уровне, что при НТН технически невыполнимо; опиоидные анальгетики, оказывающие центральное действие, и адъювантные анальгетики, к которым можно отнести антидепрессанты, усиливающие ингибирующее влияние антиноцицептивных систем, и противоэпилептические препараты, тормозящие проведение ноцицептивных стимулов на сегментарном и супрасегментарном уровнях. Эффективность препаратов, применяемых в различных комбинациях в предлагаемых схемах, различна [3]. В этой связи изучение эффективности и безопасности применения прегабалина (Лирика) и карбамазепина в комплексном лечении НТН представляется своевременным и актуальным.
Целью настоящего исследования является совершенствование методов комплексного лечения пациентов, страдающих НТН в стадии обострения, посредством сравнительного анализа терапевтической эффективности прегабалина (Лирика) и карбамазепина в комплексном лечении.
Материалы и методы
В настоящее исследование были включены 35 пациентов с НТН. Длительность заболевания – от 2 до 11 лет. Все наблюдаемые находились на амбулаторном лечении в консультативно-диагностическом центре Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского. Возраст больных – от 48 до 63 лет. Критериями включения в исследование были: обострение хронического болевого синдрома не более 2-х нед.
В стандартное комплексное лечение входили витаминотерапия, антиоксиданты, анксиолитики, антидепрессанты и противоэпилептические препараты.
Научным обоснованием применения антидепрессантов являются данные о недостаточности (функциональной и/или морфологической) антиноцицептивных систем. Известно, что антиноцицептивные системы осуществляют ингибирующий контроль сегментарного ноцицептивного аппарата челюстно-лицевой области, расположенного в каудальной части ядра спинального тракта тройничного нерва. Указанные системы, к которым относится околоводопроводное серое вещество, крупноклеточное ядро ствола головного мозга, голубое пятно и др., являются серотонин- и норадреналинергическими и участвуют, наряду с антиноцицептивным контролем, в эмоциональных реакциях человека. Поэтому применение препаратов с агонистическими моноаминергическими свойствами при лечении хронической боли является вполне обоснованным.
Возможно использование антидепрессантов различных фармакологических групп: трициклические (амитриптилин), селективные ингибиторы обратного захвата серотонина (флуоксетин), селективные ингибиторы обратного захвата серотонина и норадреналина, агонисты мелатониновых рецепторов. В нашем наблюдении применялся пипофезин (атипичный трициклический антидепрессант) в дозе 75 мг/сут.
В программу комплексной фармакотерапии НТН были включены противоэпилептические препараты. В зависимости от применяемого комплекса лечения все пациенты были разделены на 2 группы.
Группа 1 (15 человек) получала карбамазепин (средняя суточная доза карбамазепина составила 700±230 мг), группа 2 (20 человек) получала прегабалин (Лирика): 8 пациентов в дозе 450 мг/сут, 12 – 600 мг/сут. В комплексную фармакотерапию пациентов обеих групп входил пипофезин 75 мг/сут.
В обеих группах не выявлено достоверных различий по возрастному и половому составу (табл. 1).
У наблюдаемых пациентов с НТН было типичное течение заболевания – обострение начиналось с простреливающих болей в проекции одного или двух зубов, активизации имевших место ранее триггерных зон, которые располагались в медиальной части лица (верхняя губа, крыло носа) или в пародонте зубов. В подавляющем большинстве случаев провоцирующим обострение фактором явились резкое изменение АД, стресс, перепады температур. Далее развивались приступы интенсивной боли. У пациентов имелись активные триггерные зоны, раздражение которых (умывание, еда, бритье) вызывало пароксизм боли.
Обследование пациентов проводилось в два этапа – при первичном обращении и через 4 нед. после начала лечения. Комплексное обследование включало: неврологический осмотр; тестирование по шкале депрессии Бека; исследование болевого синдрома с помощью визуально-аналоговой 10-балльной шкалы боли (ВАШ) и болевого опросника Мак-Гилла. С целью изучения состояния ноцицептивных и антиноцицептивных систем на спинальном и супраспинальном уровнях проводилась регистрация ноцицептивного флексорного рефлекса, что позволило количественно оценить порог боли у больных НТН, и экстероцептивной супрессии произвольной ЭМГ-активности жевательной и височной мышц с обеих сторон.
Результаты
Динамика клинических показателей в группах наблюдения представлена в таблице 2.
Как следует из таблицы 2, в начале наблюдения интенсивность боли по ВАШ в группе 1, в комплексное лечение в которой входил карбамазепин, в среднем составила 6,8±1,3 балла, в группе 2, в комплексное лечение в которой входил прегабалин (Лирика), – 6,9±1,2 балла.
Исходный уровень депрессии по шкале Бека до лечения в обеих группах был достоверно высокий (27 и более баллов) (р<0,001): в первой группе – у 77,3%, во второй – у 72,4% больных.
Ранговый уровень боли по болевому опроснику Мак-Гилла достоверно (р<0,01) отличался в исходных группах, без существенных отличий по группам наблюдения.
При втором, заключительном этапе наблюдения, в первой группе уровень боли по ВАШ снизился с 6,8 до 2,5 баллов, во второй – с 6,9 до 1,2 баллов соответственно (рис. 1).
Психометрическое исследование в начале и в конце курса лечения показало, что число больных с высоким уровнем депрессивности в обеих группах в конце курса лечения снизилось за счет увеличения числа таковых со средними значениями депрессивности. При этом, среди пациентов, принимавших прегабалин (Лирика), число больных с высоким уровнем депрессивности значительно уменьшилось, по сравнению с группой больных, принимавших карбамазепин (44,8 и 36,4% соответственно) (рис. 2).
Результаты нейрофизиологических исследований
Ноцицептивный флексорный рефлекс. При регистрации ноцицептивного флексорного рефлекса (НФР) у больных как 1, так и 2 группы каких-либо достоверных различий параметров НФР – порога боли (Пб), порога рефлекса (Пр) и их соотношения (Пб/Пр) – после лечения обнаружено не было (p>0,1).
Экстероцептивная супрессия произвольной активности височной и жевательной мышц. При регистрации экстероцептивной супрессии (ЭC) произвольной ЭМГ-активности жевательной и височной мышц с обеих сторон как в группе 1, так и в группе 2 достоверных изменений латентного периода (ЛП) и длительностей ЭС1 после лечения обнаружено не было (p>0,1). Основные изменения, выявленные у больных с НТН после курса проведенной терапии, касались параметров поздней ЭС2. В обеих группах больных после лечения наблюдалось достоверное уменьшение величины ЛП и увеличение длительности периода ЭС2 ЭМГ активности височной и жевательной мышц при регистрации как с больной, так и со здоровой стороны, которые, однако, не достигали значений этих параметров, зарегистрированных у здоровых испытуемых (p<0,04–0,05).
В таблице 3 показана динамика параметров поздней ЭС2 произвольной активности височной и жевательной мышц в группах 1 и 2 до и после проведенной терапии.
Наблюдение за пациентами обеих групп в процессе лечения показало, что в группе больных, в комплексное лечение которых входил карбамазепин, отмечены следующие побочные явления: выраженное головокружение и атаксия у 12 человек, дискомфорт со стороны ЖКТ (боли в эпигастрии после приема препарата, диспептические расстройства) – у 7 человек; в группе больных, принимавших прегабалин (Лирика), у 3 пациентов были жалобы на сонливость в течение первых 3-х дней титрования. Указанные нежелательные проявления терапии прегабалином (Лирика) полностью регрессировали в процессе дальнейшего титрования препарата. В целом переносимость прегабалина (Лирика) была значительно лучше, чем карбамазепина. Один пациент отказался от приема карбамазепина в связи с плохой переносимостью препарата. Отказа от терапии прегабалином (Лирика) не было.
Динамика болевого синдрома в процессе лечения была следующей: регресс боли более чем на 50% по истечении 2-х нед. приема препаратов наблюдался у 12 (60%) больных, принимавших прегабалин (Лирика), и у 7 (42,3%) пациентов, лечившихся карбамазепином. Полный регресс болевого синдрома по истечении 4 нед. от начала приема терапевтически эффективной дозы препарата отмечен у 9 (60%) больных, принимавших карбамазепин, и у 14 (70%) человек, лечившихся прегабалином (Лирика).
Предикторы эффективности лечения
С целью определения предикторов эффективности терапии мы разделили всех закончивших курс лечения пациентов с НТН на 2 подгруппы в зависимости от степени купирования болевого синдрома через 4 нед. от начала приема индивидуальной эффективной дозы. В подгруппу 1 вошли пациенты с НТН с полным регрессом боли – 9 человек, лечившихся карбамазепином, и 12, лечившихся прегабалином (Лирика). В подгруппу 2 вошли 12 пациентов с НТН по 6 из каждой группы наблюдения, у которых наблюдалось уменьшение боли ≥ 50% от исходного значения. Для выявления факторов, влияющих на эффективность лечения, мы провели сравнительный анализ пациентов этих 2-х подгрупп по клиническим, психологическим и нейрофизиологическим показателям до начала терапии.
В таблице 4 представлены клинические, психологические и нейрофизиологические показатели, по которым пациенты с НТН подгруппы 1 достоверно отличаются от больных с НТН подгруппы 2.
На основании проведенного анализа можно сделать заключение, что пациенты, у которых за 4 нед. лечения была достигнута медикаментозная ремиссия (полный регресс боли), характеризовались:
1) меньшей длительностью заболевания НТН;
2) меньшей длительностью пароксизмов боли;
3) меньшим количеством приступов в день;
4) меньшим количеством больных с присоединившимся миофасциальным болевым синдромом лица;
5) меньшей степенью депрессивности;
6) меньшим уровнем личностной тревоги;
7) меньшей интенсивностью боли;
 более длинным латентным периодом ЭС2;
более длинным латентным периодом ЭС2;
9) меньшей длительностью периода ЭС2.
Выводы
Применение противоэпилептических препаратов в комплексном лечении больных с НТН является эффективным и безопасным.
1. Прегабалин (Лирика) в сопоставимых дозировках показывает более высокую противоболевую активность, лучше переносится пациентами и вызывает меньше побочных эффектов.
2. Большая длительность НТН, высокая (более 5) частота приступов, высокий уровень депрессивности и тревоги являются клиническими предикторами неблагоприятного прогноза эффективности противоболевой терапии НТН.
Когда следует обратиться к врачу
При появлении симптомов невралгии тройничного нерва необходимо сразу обратиться к врачу, поскольку она может быть признаком другого серьезного заболевания. В лечении неврологических патологий крайне важна точная и своевременная диагностика. Этим занимается невролог, к которому вы можете записаться в нашей клинике в центре Москвы. Специалист знает не только, как снять невралгию тройничного нерва, но и как правильно ее диагностировать, чтобы в дальнейшем назначить эффективное лечение.
Финлепсин® (Finlepsin® )
Монотерапию эпилепсии начинают с назначения низкой начальной дозы, постепенно повышая ее до достижения желаемого терапевтического эффекта.
При подборе оптимальной дозы целесообразно определять концентрацию карбамазепина в плазме крови, в особенности при комбинированной терапии. В отдельных случаях оптимальная доза может значительно отклоняться от рекомендуемой начальной и поддерживающей дозы, например, в связи с индукцией микросомальных ферментов печени или по причине взаимодействий при комбинированной терапии.
Финлепсин® не следует комбинировать с седативно-гипнотическими средствами. При необходимости его можно сочетать с другими веществами, применяемыми для лечения алкогольной абстиненции. В ходе лечения необходимо регулярно контролировать содержание карбамазепина в плазме крови. В связи с развитием побочных действий со стороны центральной и вегетативной нервной системы за больными устанавливают тщательное наблюдение в условиях стационара. При переводе больного на карбамазепин следует постепенно снижать дозу ранее назначенного противоэпилептического средства вплоть до его полной отмены. Внезапное прекращение приема карбамазепина может спровоцировать эпилептические приступы. Если необходимо резко прервать лечение, следует перевести больного на другое противоэпилептическое средство под прикрытием показанного в таких случаях препарата (например, диазепама, вводимого внутривенно или ректально, или фенитоина, вводимого внутривенно).
Описано несколько случаев рвоты, диареи и/или пониженного питания, судорог и/или угнетения дыхания у новорожденных, матери которых принимали карбамазепин одновременно с другими противосудорожными препаратами (возможно, эти реакции представляют собой проявления у новорожденных синдрома отмены). Перед назначением карбамазепина и в процессе лечения необходимо исследование функции печени, особенно у пациентов, в анамнезе которых имеются сведения о заболеваниях печени, а также у пациентов пожилого возраста. В случае усиления уже имевшихся нарушений функции печени или при появлении активного заболевания печени препарат следует немедленно отменить. Перед началом лечения необходимо провести исследование картины крови (включая подсчет тромбоцитов, ретикулоцитов), уровня железа в сыворотке крови, общего анализа мочи, уровня мочевины в крови, электроэнцефалограмму, определение концентрации электролитов в сыворотке крови (и периодически во время лечения, т.к. возможно развитие гипонатриемии). Впоследствии эти показатели следует контролировать в течение первого месяца лечения еженедельно, а затем — ежемесячно.
В большинстве случаев преходящее или стойкое снижение числа тромбоцитов и/или лейкоцитов не являются предвестниками начала апластической анемии или агранулоцитоза. Тем не менее, перед началом лечения, а также периодически в процессе лечения следует проводить клинические анализы крови, включая подсчет числа тромбоцитов и, возможно, ретикулоцитов, а также определять уровень железа в сыворотке крови. Непрогрессирующая асимптоматическая лейкопения не требует отмены, однако, лечение следует прекратить при появлении прогрессирующей лейкопении или лейкопении, сопровождающейся клиническими симптомами инфекционного заболевания. Карбамазепин должен быть немедленно отменен при появлении реакций гиперчувствительности или симптомов, предположительно свидетельствующих о развитии синдрома Стивенса-Джонсона или синдрома Лайелла. Слабо выраженные кожные реакции (изолированная макулезная или макулопапулезная экзантема) обычно проходят в течение нескольких дней или недель даже при продолжении лечения или после снижения дозы препарата (пациент в это время должен находиться под пристальным наблюдением врача).
Следует принимать во внимание возможность активации латентно протекающих психозов, а у пациентов пожилого возраста — возможность развития дезориентации или психомоторного возбуждения.
В некоторых случаях лечение противоэпилептическими препаратами сопровождалось возникновением суицидальных попыток/суицидальных намерений. Это было также подтверждено при проведении мета-анализа рандомизированных клинических испытаний с применением противоэпилептических средств. Поскольку механизм возникновения суицидальных попыток при использовании противоэпилептических препаратов не известен, нельзя исключить их возникновение и при лечении больных препаратом Финлепсин®. Пациентов и обслуживающий персонал нужно предупредить о необходимости следить за появлением суицидальных мыслей/суицидального поведения и в случае возникновения симптомов немедленно обращаться за медицинской помощью.
Возможны нарушения мужской фертильности и/или нарушения сперматогенеза, однако взаимосвязь этих нарушений с приемом карбамазепина пока не установлена.
Возможно появление межментсруальных кровотечений при одновременном применении оральных контрацептивов. Карбамазепин может отрицательно повлиять на надежность пероральных контрацептивных препаратов, поэтому женщинам репродуктивного возраста в период лечения следует применять альтернативные методы предохранения от беременности.
Карбамазепин должен применяться только под врачебным наблюдением. Необходимо довести до сведения пациентов информацию о ранних признаках токсичности, а также о симптомах со стороны кожных покровов и печени. Пациента информируют о необходимости немедленно обратиться к врачу в случае появления таких нежелательных реакций, как лихорадка, боли в горле, сыпь, изъязвлении слизистой полости рта, беспричинное возникновение синяков, геморрагии в виде петехий или пурпуры.
Перед началом лечения рекомендуется провести офтальмологическое обследование, включая исследование глазного дна и измерение внутриглазного давления. В случае назначения препарата пациентам с повышением внутриглазного давления требуется постоянный контроль этого показателя.
Больным с тяжелыми сердечно-сосудистыми заболеваниями, поражениями печени и почек, а также лицам пожилого возраста назначают более низкие дозы препарата. Хотя взаимосвязь между дозой карбамазепина, его концентрацией и клинической эффективностью или переносимостью весьма незначительна, тем не менее, регулярное определение уровня карбамазепина может оказаться полезным в следующих ситуациях: при резком повышении частоты приступов; для того, чтобы проверить, принимает ли пациент препарат должным образом; во время беременности; при лечении детей или подростков; при подозрении на нарушения всасывания препарата; при подозрении на развитие токсических реакций в случае, если пациент принимает несколько лекарственных средств.
Во время лечения препаратом Финлепсин® рекомендуется воздержаться от употребления алкоголя.
Диагностика невралгии тройничного нерва
Предварительный диагноз может быть поставлен неврологом уже на основании жалоб пациента, изучения истории его заболевания и объективного осмотра лица с оценкой симметричности в состоянии покоя и при попытке улыбнуться. Также в процессе консультации врач может провести дополнительные тесты, попросив пациента зажмурить глаза, сложить губы трубочкой, нахмурить брови и пр.
Лабораторная и инструментальная диагностика невралгии тройничного нерва включают следующие обследования:
- общие анализы крови и мочи;
- компьютерная (КТ) и магнитно-резонансная томография (МРТ);
- рентгенография придаточных пазух носа;
- панорамная рентгенография полости рта;
- электронейромиография для определения локализации воспаления.
Финлепсин
Применение при беременности и кормлении грудью
Женщинам репродуктивного возраста Финлепсин® по возможности назначается в виде монотерапии, в минимально эффективной дозе, т.к. частота врожденных аномалий новорожденных от матерей, принимавших комбинированное противоэпилептическое лечение, выше, чем при монотерапии.
При наступлении беременности необходимо сопоставить ожидаемую пользу терапии и возможные осложнения, особенно в I триместре беременности. Известно, что дети матерей, страдающих эпилепсией, предрасположены к нарушениям внутриутробного развития, включая пороки развития. Финлепсин® способен повышать риск возникновения этих нарушений. Имеются единичные сообщения о случаях врожденных заболеваний и пороков развития, включая незаращение дужек позвонков (spina bifida). Противоэпилептические средства усиливают дефицит фолиевой кислоты, часто наблюдающийся во время беременности, что может способствовать увеличению частоты врожденных дефектов у детей, поэтому до наступления планируемой беременности и во время беременности рекомендуется прием фолиевой кислоты.
С целью профилактики геморрагических осложнений у новорожденных, женщинам в последние недели беременности, а также новорожденным рекомендуется назначать витамин К.
Карбамазепин проникает в грудное молоко, поэтому следует сопоставить пользу и возможные нежелательные последствия грудного вскармливания в условиях продолжающейся терапии. При продолжении грудного вскармливания на фоне приема Финлепсина следует установить наблюдение за ребенком в связи с возможностью развития побочных реакций (например, выраженной сонливости, аллергических кожных реакций).
Применение при нарушениях функции печени
С осторожностью препарат следует применять при нарушении функции печени.
Применение при нарушениях функции почек
С осторожностью препарат следует применять при нарушении функции почек.
Применение у детей
Возможно применение у детей по показаниям.
Особые указания
Монотерапию эпилепсии начинают с назначения низкой начальной дозы, постепенно повышая ее до достижения желаемого терапевтического эффекта.
При подборе оптимальной дозы целесообразно определять концентрацию карбамазепина в плазме крови, в особенности при комбинированной терапии. В отдельных случаях оптимальная доза может значительно отклоняться от рекомендуемой начальной поддерживающей дозы, например, в связи с индукцией микросомальных ферментов печени или по причине взаимодействий при комбинированной терапии.
В некоторых случаях лечение противоэпилептическими препаратами сопровождалось возникновением суицидальных попыток/суицидальных намерений. Это было также подтверждено при проведении мета-анализа рандомизированных клинических испытаний с применением противоэпилептических средств. Поскольку механизм возникновения суицидальных попыток при использовании противоэпилептических препаратов не известен, нельзя исключить их возникновение и при лечении препаратом Финлепсин®. Пациентов и обслуживающий персонал нужно предупредить о необходимости следить за появлением суицидальных мыслей/суицидального поведения, и в случае возникновения симптомов немедленно обращаться за медицинской помощью.
Финлепсин® не следует комбинировать с седативно-снотворными средствами. При необходимости его можно сочетать с другими веществами, применяемыми для лечения алкогольной абстиненции. В ходе лечения необходимо регулярно контролировать содержание карбамазепина в плазме крови. В связи с развитием побочных эффектов со стороны ЦНС и вегетативной нервной системы за пациентами устанавливают тщательное наблюдение в условиях стационара.
При переводе больного на карбамазепин следует постепенно снижать дозу ранее назначенного противоэпилептического средства вплоть до его полной отмены. Внезапное прекращение приема карбамазепина может спровоцировать эпилептические приступы. Если необходимо резко прервать лечение, следует перевести больного на другое противоэпилептическое средство под прикрытием показанного в таких случаях препарата (например, диазепама, вводимого в/в или ректально, или фенитоина, вводимого в/в).
Описано несколько случаев рвоты, диареи и/или пониженного питания, судорог и/или угнетения дыхания у новорожденных, матери которых принимали карбамазепин одновременно с другими противосудорожными препаратами (возможно, эти реакции представляют собой проявления у новорожденных синдрома отмены).
Перед назначением карбамазепина и в процессе лечения необходимо исследование функции печени, особенно у пациентов, в анамнезе которых имеются сведения о заболеваниях печени, а также у пациентов пожилого возраста. В случае усиления уже имевшихся нарушений функции печени или при появлении активного заболевания печени препарат следует немедленно отменить.
Перед началом лечения необходимо провести исследование картины крови (включая подсчет тромбоцитов, ретикулоцитов), уровня железа в сыворотке крови, общего анализа мочи, уровня мочевины в крови, электроэнцефалограмму, определение концентрации электролитов в сыворотке крови (и периодически во время лечения, т.к. возможно развитие гипонатриемии). Впоследствии эти показатели следует контролировать в течение первого месяца лечения еженедельно, а затем — ежемесячно.
В большинстве случаев преходящее или стойкое снижение числа тромбоцитов и/или лейкоцитов не являются предвестниками начала апластической анемии или агранулоцитоза. Тем не менее, перед началом лечения, а также периодически в процессе лечения следует проводить клинические анализы крови, включая подсчет числа тромбоцитов и, возможно, ретикулоцитов, а также определять уровень железа в сыворотке крови. Непрогрессирующая асимптоматическая лейкопения не требует отмены, однако лечение следует прекратить при появлении реакций гиперчувствительности или симптомов, предположительно свидетельствующих о развитии синдрома Стивенса-Джонсона или синдрома Лайелла. Слабо выраженные кожные реакции (изолированная макулезная или макулопапулезная экзантема) обычно проходят в течение нескольких дней или недель даже при продолжении лечения или после снижения дозы препарата (пациент в это время должен находиться под пристальным наблюдением врача).
Следует принимать во внимание возможность активации латентно протекающих психозов, а у пациентов пожилого возраста — возможность развития дезориентации или психомоторного возбуждения.
Возможны нарушения мужской фертильности и/или нарушения сперматогенеза, однако взаимосвязь этих нарушений с приемом карбамазепина пока не установлена.
Возможно появление межменструальных кровотечений при одновременном применении пероральных контрацептивов. Карбамазепин может отрицательно повлиять на надежность пероральных контрацептивных препаратов, поэтому женщинам репродуктивного возраста в период лечения следует применять альтернативные методы предохранения от беременности. Карбамазепин должен применяться только под врачебным наблюдением.
Необходимо довести до сведения пациентов информацию о ранних признаках токсичности, а также о симптомах со стороны кожных покровов и печени. Пациента информируют о необходимости немедленно обратиться к врачу в случае появления таких нежелательных реакций, как лихорадка, боли в горле, сыпь, изъязвлении слизистой оболочки полости рта, беспричинное возникновение синяков, геморрагий в виде петехий или пурпуры.
Перед началом лечения рекомендуется провести офтальмологическое обследование, включая исследование глазного дна щелевой лампой и измерение внутриглазного давления. В случае назначения препарата пациентам с повышением внутриглазного давления требуется постоянный контроль этого показателя.
Больным с тяжелыми сердечно-сосудистыми заболеваниями, поражениями печени и почек, а также лицам пожилого возраста назначают более низкие дозы препарата.
Хотя взаимосвязь между дозой карбамазепина, его концентрацией и клинической эффективностью или переносимостью весьма незначительна, тем не менее, регулярное определение уровня карбамазепина может оказаться полезным в следующих ситуациях: при резком повышении частоты приступов; для того, чтобы проверить, принимает ли пациент препарат должным образом; во время беременности; при лечении детей или подростков; при подозрении на нарушения всасывания препарата; при подозрении на развитие токсических реакций в случае, если пациент принимает несколько лекарственных средств.
Во время лечения Финлепсином рекомендуется воздержаться от употребления алкоголя.
Влияние на способность к вождению автотранспорта и управлению механизмами
В период лечения необходимо воздерживаться от занятий потенциально опасными видами деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций.
Лечение
Лечение воспаления тройничного нерва проводится в зависимости от степени выраженности симптомов. Сначала назначается консервативная терапия. Если она не помогает, врачи прибегают к хирургическим методам. Их суть заключается в устранении причины невралгии. Это может быть сдавливание нерва сосудом. Хирургическое лечение проводится методом радиочастотной деструкции, микрососудистой декомпрессии или чрескожной операции.
Какие препараты для лечения невралгии тройничного нерва наиболее эффективны:
- антибиотики. Назначаются при инфекционной природе заболевания;
- глюкокортикостероиды. Снимают сильное воспаление в организме;
- нестероидные противовоспалительные препараты (НПВС). Способствуют угнетению воспалительных процессов;
- обезболивающие. Снимают болезненность в лицевых мышцах;
- миорелаксанты.
Для улучшения обменных процессов в нервной ткани пациенту назначают витамины группы B. Как снять острую боль при невралгии тройничного нерва:
- использовать противосудорожные препараты;
- обеспечить физический покой, лучше – постельный режим;
- нанести на место локализации боли противовоспалительную мазь или сделать согревающий компресс.
Современный подход к лечению тригеминальной невралгии
Тригеминальная невралгия (ТН) (синонимы: tic douloureux, или болезнь Фотергилла) является одной из самых распространенных лицевых болей (прозопалгий) и относится к числу наиболее устойчивых болевых синдромов в клинической неврологии [1]. ТН является типичным примером нейропатической боли (НБ) пароксизмального характера и считается самым мучительным видом прозопалгии. ТН чаще всего имеет хроническое или рецидивирующее течение, сопровождается большим количеством коморбидных расстройств, гораздо труднее поддается лечению, чем многие другие типы хронической боли и приводит к временной или постоянной нетрудоспособности, что делает ее большой экономической и социальной проблемой [2]. Хроническая НБ оказывает значительное отрицательное воздействие на качество жизни пациентов, вызывая нарушения сна, усиление тревоги, депрессии, снижение повседневной активности [3]. Высокая интенсивность и стойкость ТН, ее особый, часто мучительный характер, резистентность к традиционным методам обезболивания придают этой проблеме исключительную актуальность. Тригеминальная невралгия — заболевание, характеризующееся возникновением приступообразной, обычно односторонней, кратковременной, острой, резкой, интенсивной, напоминающей удар электрическим током, боли в области иннервации одной или нескольких ветвей тройничного нерва [4, 5]. Чаще всего поражение возникает в зоне II и/или III ветви и крайне редко — I ветви n. trigeminus [6].
По данным ВОЗ распространенность ТН составляет до 30–50 больных на 100 000 населения, а заболеваемость — 2–4 человека на 100 000 населения. ТН чаще встречается у женщин, чем у мужчин, дебютирует на пятом десятилетии жизни и в 60% случаев имеет правостороннюю локализацию [7, 8].
Согласно Международной классификации головных болей (2-е издание), предложенной Международным обществом головной боли (2003), ТН подразделяется на классическую, вызванную компрессией тригеминального корешка извилистыми или патологически измененными сосудами, без признаков явного неврологического дефицита, и симптоматическую, вызванную доказанным структурным повреждением тройничного нерва, отличным от сосудистой компрессии [9].
Наиболее частой причиной возникновения ТН является компрессия проксимальной части тригеминального корешка в пределах нескольких миллиметров от входа корешка в мост мозга (т. н. «входная зона корешка»). Примерно в 80% случаев происходит компрессия артериальным сосудом (чаще всего патологически извитой петлей верхней мозжечковой артерии). Этим объясняется тот факт, что ТН возникает в пожилом и старческом возрасте и практически не встречается у детей. В остальных случаях таковая компрессия вызвана аневризмой базилярной артерии, объемными процессами в задней черепной ямке, опухолями мостомозжечкового угла и бляшками рассеянного склероза [1, 8, 10, 11].
На экстракраниальном уровне основными факторами, приводящими к возникновению ТН, являются: туннельный синдром — компрессия в костном канале, по которому проходит нерв (чаще в подглазничном отверстии и нижней челюсти), связанная с его врожденной узостью, присоединением сосудистых заболеваний в пожилом возрасте, а также в результате хронического воспалительного процесса в смежных зонах (кариес, синуситы); местный одонтогенный или риногенный воспалительные процессы. Развитие ТН может провоцироваться инфекционными процессами, нейроэндокринными и аллергическими заболеваниями, демиелинизацией корешка тройничного нерва при рассеянном склерозе [7, 12].
В зависимости от воздействия патологического процесса на соответствующий отдел тригеминальной системы выделяют ТН преимущественно центрального и периферического генеза. В возникновении ТН центрального генеза большую роль играют нейроэндокринные, иммунологические и сосудистые факторы, которые приводят к нарушению реактивности корково-подкорковых структур и формированию очага патологической активности в ЦНС. В патогенезе ТН периферического уровня большую роль играют компрессионный фактор, инфекции, травмы, аллергические реакции, одонтогенные процессы [7, 8, 12].
Несмотря на появившееся в последние годы большое количество обзоров литературы и метаанализов, посвященных проблеме лечения НБ [13], к которой относится и ТН, среди исследователей не существует единого мнения относительно основных принципов медикаментозной терапии этого заболевания [14]. Лечение нейропатической боли все еще остается недостаточно эффективным: менее чем у половины пациентов отмечается значительное улучшение в результате проведенного фармакологического лечения [15, 16].
Проблема терапии тригеминальной невралгии на сегодняшний день остается не до конца решенной, что связано с неоднородностью данного заболевания в отношении этиологии, патогенетических механизмов и симптоматики, а также с малой эффективностью обычных анальгетических средств и развитием фармакорезистентных форм ТН, требующих проведения хирургического лечения. В современных условиях лечебная тактика при данном заболевании включает в себя медикаментозные и хирургические методы.
Основными направлениями медикаментозной терапии являются: устранение причины ТН, если она известна (лечение больных зубов, воспалительных процессов смежных зон и др.), и проведение симптоматического лечения (купирование болевого синдрома).
Патогенетическое лечение больных с ТН включает применение препаратов нейрометаболического, нейротрофического, антиоксидантного, антигипоксантного действия. В последние годы обнаружена высокая эффективность использования метаболических препаратов в комплексном лечении НБ [8, 17]. При лечении пациентов с ТН показана высокая эффективность препарата метаболического действия Актовегина — депротеинизированного деривата из крови молодых телят. Основное действие этого препарата заключается в стабилизации энергетического потенциала клеток за счет повышения внутриклеточного транспорта и утилизации глюкозы и кислорода. Актовегин обладает также антигипоксическим эффектом, являясь непрямым антиоксидантом. Кроме того, действие Актовегина проявляется непрямым вазоактивным и реологическим эффектами за счет повышения капиллярного кровотока, снижения периферического сосудистого сопротивления и улучшения перфузии органов и тканей [17]. Такой широкий спектр фармакологического действия Актовегина позволяет использовать его в терапии ТН. В период приступа целесообразно применение Актовегина внутривенно медленно струйно или капельно в течение 10 дней в дозе 400–600 мг/сутки. В межприступном периоде препарат назначается внутрь в дозе 200 мг 3 раза в сутки на протяжении 1–3 месяцев [8]. К патогенетическому лечению больных с ТН можно отнести применение высоких доз витаминов группы B в составе поликомпонентных препаратов, что обусловлено их полимодальным нейротропным действием (влиянием на обмен веществ, метаболизм медиаторов, передачу возбуждения в нервной системе), а также способностью существенно улучшать регенерацию нервов. Кроме того, витамины группы B обладают анальгезирующей активностью. К таким препаратам, в частности, относятся Мильгамма, Нейромультивит, Нейробион, содержащие сбалансированную комбинацию тиамина (B1), пиридоксина (B6), цианокобаламина (B12). Витамин B1 устраняет ацидоз, снижающий порог болевой чувствительности; активирует ионные каналы в мембранах нейронов, улучшает эндоневральный кровоток, повышает энергообеспечение нейронов и поддерживает аксоплазматический транспорт белков. Эти эффекты тиамина способствуют регенерации нервных волокон [18–20]. Витамин B6, активируя синтез миелиновой оболочки нервного волокна и транспортных белков в аксонах, ускоряет процесс регенерации периферических нервов, проявляя тем самым нейротропный эффект. Восстановление синтеза ряда медиаторов (серотонина, норадреналина, дофамина, гамма-аминомасляной кислоты (ГАМК) и активация нисходящих тормозных серотонинергических путей, входящих в антиноцицептивную систему, приводит к снижению болевой чувствительности (антиноцицептивное действие пиридоксина) [18, 21]. Витамин B12 участвует в процессах регенерации нервной ткани, активируя синтез липопротеинов, необходимых для построения клеточных мембран и миелиновой оболочки; уменьшает высвобождение возбуждающих нейротрансмиттеров (глутамата); обладает противоанемическим, гемопоэтическим и метаболическим эффектом [18, 22]. Для быстрого купирования боли и патогенетического нейротропного воздействия при ТН целесообразно использование парентеральной формы препарата Нейробион — комбинированного препарата витаминов группы B, содержащего оптимальное количество витамина B12 как в ампулированной, так и в таблетированной форме. Нейробион применяется в дозе 3 мл в сутки внутримышечно 2–3 раза в неделю — 10 инъекций (при выраженном болевом синдроме можно применять ежедневно в той же дозировке в течение 10–15 дней). Затем для усиления, пролонгирования терапевтического эффекта и профилактики рецидива заболевания назначается Нейробион в таблетированной форме в дозировке по 1 таблетке внутрь 3 раза в день в течение 1–2 месяцев [8].
Также препаратами выбора для лечения ТН являются антиконвульсанты, а карбамазепин стал одним из первых препаратов, официально зарегистрированных для лечения этого состояния [24].
В начале 90-х годов прошлого столетия появилась новая генерация противоэпилептических препаратов, и теперь антиконвульсанты обычно делят на препараты первого и второго поколения.
К антиконвульсантам первого поколения относятся фенитоин, фенобарбитал, примидон, этосуксимид, карбамазепин, вальпроевая кислота, диазепам, лоразепам, клоназепам. Препараты первого поколения практически не рассматриваются в качестве первой линии терапии НБ (за исключением карбамазепина при ТН) из-за недостаточного уровня обезболивающего эффекта и высокого риска возникновения нежелательных реакций. К наиболее частым побочным эффектам антиконвульсантов первого поколения относятся: реакции со стороны ЦНС (сонливость, головокружение, атаксия, седативный эффект или повышенная возбудимость, диплопия, дизартрия, когнитивные расстройства, ухудшение памяти и настроения), гематологические нарушения (агранулоцитоз, апластическая анемия, тромбоцитопения, лейкопения), гепатотоксичность, снижение минеральной плотности кости, кожные высыпания, гиперплазия десен, симптомы со стороны желудочно-кишечного тракта (рвота, анорексия). К антиконвульсантам второго поколения относятся прегабалин (Лирика), габапентин (Нейронтин, Габагамма, Тебантин), ламотриджин (Ламиктал), окскарбазепин (Трилептал), топирамат (Топамакс), леветирацетам (Кеппра), тиагабин (Габитрил), зонисамид (Зонегран), вигабатрин (Сабрил), фелбамат (Талокса). Эти препараты имеют более благоприятные фармакокинетические характеристики и профили безопасности, а также низкий риск лекарственных взаимодействий по сравнению с антиконвульсантами первого поколения [24, 25].
Основные механизмы действия антиконвульсантов 1-го и 2-го поколения представлены в таблице [26].
Первым антиконвульсантом, успешно используемым для лечения ТН, был фенитоин (Дифенин) [27]. Дифенин, производное гидантоина, близкого по химической структуре к барбитуровой кислоте, противопоказан при тяжелых заболеваниях почек, печени, сердечной недостаточности.
Согласно рекомендациям Европейской федерации неврологических сообществ (2009) фармакотерапия ТН основана, прежде всего, на использовании предложенного С. Блюмом в 1962 году карбамазепина (Финлепсина, Тегретола) (200–1200 мг/сутки), который является препаратом первого выбора (уровень доказательности A) [27, 28]. Противоболевое действие этого препарата обусловлено, главным образом, его способностью уменьшать проницаемость для натрия мембран нейронов, участвующих в ноцицептивных реакциях. Обычно назначается следующая схема лечения карбамазепином. В первые два дня суточная доза составляет 200 мг (по 1/2 таблетки утром и вечером), затем в течение двух дней суточная доза увеличивается до 400 мг (утром и вечером), а после этого — до 600 мг (по 1 таблетке утром, в обед и вечером). Если эффект недостаточный, то общее количество препарата в сутки может быть доведено до 800–1000 мг. У части больных ТН (около 15% в популяции) карбамазепин не оказывает анальгезирующего воздействия, поэтому в таких случаях применяется другой антиконвульсант — фенитоин.
Проведенные около 40 лет назад три плацебо-контролируемые исследования, которые включали в себя в общей сложности 150 пациентов с ТН, показали эффективность карбамазепина в отношении как частоты, так и интенсивности пароксизмов [24]. Рядом авторов было показано, что карбамазепин может уменьшить болевую симптоматику приблизительно в 70% случаев. [29]. Однако применение карбамазепина ограничено фармакокинетическими факторами и возникающими в ряде случаев тяжелыми побочными эффектами (например, синдром Стивенса–Джонсона), особенно у пожилых пациентов.
Окскарбазепин (Трилептал) имеет структурное сходство с карбамазепином, но гораздо лучше переносится пациентами и имеет гораздо меньше побочных эффектов. Обычно окскарбазепин используется в начале лечения ТН в дозе 600–1800 мг/сутки (уровень доказательности B) [30].
В качестве дополнительной терапии ТН показана эффективность ламотриджина (Ламиктала) в дозе 400 мг/сутки [31] и баклофена в дозе 40–80 мг/сутки [32], которые относятся к препаратам второй линии (уровень доказательности C). Малые открытые исследования (класс IV) свидетельствуют об эффективности применения клоназепама, вальпроата, фенитоина [33, 34]. Указанная терапия наиболее эффективна при классической форме ТН. При ТН периферического генеза в схемы лечения предпочтительно включать ненаркотические анальгетики, а в случае развития хронического болевого синдрома (более трех месяцев) показано назначение антидепрессантов (амитриптилин) [7, 12].
Габапентин (Нейронтин) — первый в мире препарат, который был зарегистрирован для лечения всех видов нейропатической боли. Во многих исследованиях была показана эффективность габапентина у больных с ТН, не отвечающих на лечение другими средствами (карбамазепин, фенитоин, вальпроаты, амитриптилин); при этом в большинстве случаев наблюдалось полное купирование болевого синдрома [35]. Терапевтическая доза составляет от 1800 до 3600 мг/сутки. Препарат принимают 3 раза в сутки по следующей схеме: 1-я неделя — 900 мг/сутки, 2-я неделя — 1800 мг/сутки, 3-я неделя — 2400 мг/сутки, 4-я неделя — 3600 мг/сутки.
Недавно были опубликованы результаты открытого проспективного 12-месячного исследования 53 пациентов с ТН, в котором оценивалась эффективность прегабалина (Лирики) в дозе 150–600 мг/сутки. Лечение прегабалином привело к обезболиванию или, по крайней мере, к 50%-му снижению интенсивности боли у 25% и 49% пациентов соответственно [36]. В другом мультицентровом проспективном 12-недельном исследовании 65 больных, резистентных к предшествующей анальгетической терапии, лечение прегабалином в средней дозе 196 мг/сутки (в подгруппе монотерапии) и 234 мг/день (в подгруппе политерапии) приводило к уменьшению интенсивности боли ≥ 50% в среднем у 60% больных, а также уменьшало степень выраженности тревоги, депрессии и нарушений сна [37]. При лечении ТН начальная доза прегабалина может составлять 150 мг/сутки в 2 приема. В зависимости от эффекта и переносимости дозу можно увеличить до 300 мг/сутки через 3–7 дней. При необходимости можно увеличить дозу до максимальной (600 мг/сутки) через 7-дневный интервал.
Впервые об использовании леветирацетама (Кеппра) при лечении ТН сообщили в 2004 году K. R. Edwards et al. [38]. Механизм действия леветирацетама неизвестен; имеются данные, полученные в экспериментах на животных, что он является селективным блокатором N-типа кальциевых каналов [39]. Свойства этого препарата особенно подходят для лечения пациентов с ТН с тяжелой болью, нуждающихся в быстром ответе на терапию. Фармакокинетика леветирацетама линейна и предсказуема; концентрация в плазме крови увеличивается пропорционально дозе в пределах клинически обоснованного диапазона от 500 до 5000 мг [40]. В отличие от других антиконвульсантов, особенно карбамазепина, в метаболизм леветирацетама не вовлечена система печеночного цитохрома Р450 и препарат экскретируется через почки [41]. Кроме того, данный препарат характеризуется благоприятным терапевтическим индексом и имеет незначительное число неблагоприятных побочных эффектов (что является основной проблемой при использовании препаратов для лечения ТН) [42]. Побочными эффектами леветирацетама, о которых обычно сообщают, являются: астения, головокружение, сонливость, головная боль и депрессия. В 10-недельном проспективном открытом исследовании показано, что для лечения ТН по сравнению с терапией эпилепсии были необходимы более высокие дозы леветирацетама, составляющих 3000–5000 мг/день (50–60 мг/кг/день), которые, тем не менее, не вызвали значительных побочных эффектов. Это обстоятельство свидетельствует о перспективе использования этого лекарственного средства для лечения ТН [43].
В одном отечественном исследовании отмечены положительные результаты при комбинации карбамазепина и габапентина [44].
С 1970-х годов прошлого столетия для лечения ТН стали использовать антидепрессанты [45]. В настоящее время доказана эффективность использования трициклических антидепрессантов (ТЦА) при лечении ТН [46].
До настоящего времени подбор анальгезирующей терапии НБ является скорее искусством, чем наукой, поскольку выбор препаратов осуществляется в основном эмпирически. Нередки ситуации, когда применение одного препарата оказывается недостаточно эффективным и возникает потребность в комбинации лекарственных средств. Назначение «рациональной полифармакотерапии» (одновременное применение препаратов, обладающих нейротропным, нейрометаболическим и анальгезирующим механизмами действия) позволяет повысить эффективность лечения при меньших дозировках препаратов и меньшем количестве побочных эффектов [47].
Пациентам, длительно страдающим от непереносимой боли, и при неэффективности консервативной терапии в случае классической ТН рекомендуется хирургическое лечение. В настоящее время используются следующие подходы:
1) хирургическая микроваскулярная декомпрессия [48]; 2) стереотаксическая лучевая терапия, гамма-нож [49]; 3) чрескожная баллонная микрокомпрессия [50]; 4) чрескожный глицериновый ризолизис [51]; 5) чрескожное радиочастотное лечение Гассерова узла [52].
Наиболее эффективным методом хирургического лечения ТН является метод P. Janetta, заключающийся в размещении специальной прокладки между тройничным нервом и раздражающим сосудом; в отдаленном периоде эффективность лечения составляет 80% [53–55].
В заключение заметим, что лечение ТН должно носить мультидисциплинарный характер, при этом c пациентом должны быть обсуждены выбор различных методов лечения и риски возможных осложнений.
Литература
- Карлов В. А. Неврология лица. М.: Медицина, 1991. 288 с.
- O’Connor A. B. Neuropathic pain: quality-of-life impact, costs and cost effectiveness of therapy // Pharmacoeconomics. 2009. Vol. 27, № 2. P. 95–112.
- Jensen M. P., Chodroff M. J., Dworkin R. H. The impact of neuropathic pain on health-related quality of life: review and implications // Neurology. 2007. Vol. 68. P. 1178–1182.
- Болевые синдромы в неврологической практике. Под ред. А. М. Вейна. М.: МЕДпресс-информ, 2001. 368 с.
- Love S., Coakham H. B. Trigeminal neuralgia: pathology and pathogenesis // Brain. 2001. Vol. 124, № 12. P. 2347–2360.
- Турбина Л. Г., Гордеев С. А., Зусьман А. А. Тригеминальная невралгия. Эпидемиология, патогенез, клиника, диагностика, лечение // Сборник трудов Московской областной ассоциации неврологов «Всемирный день инсульта в Подмосковье 29 октября 2009 г. »: Сб. статей. М., 2009. С. 65–70.
- Грицай Н. Н., Кобзистая Н. А. Классическая невралгия тройничного нерва и одонтогенный болевой синдром // Новости медицины и формации. 2009. № 299. С. 23–25.
- Товажнянская Е. Л. Невралгия тройничного нерва: современные аспекты комплексной терапии // Междунар. неврол. журн. 2010. № 3 (33). С. 141–145.
- Международная классификация головных болей. 2-е издание. М.: «ГлаксоСмитКляйн Трейдинг», 2003. 380 с.
- Kress B., Schindler M., Rasche D. MRI volumetry for the preoperative diagnosis of trigeminal neuralgia // Eur. Radiol. 2005. Vol. 15. P. 1344–1348.
- Rasche D., Kress B., Stippich C. et al. Volumetric measurement of the pontomesencephalic cistern in patients with trigeminal neuralgia and healthy controls // Neurosurgery. 2006. Vol. 59. P. 614–620.
- Степанченко А. В. Типичная невралгия тройничного нерва. М.: Изд. Группа «ВХМ», 1994. 39 с.
- Saarto T., Wiffen P. J. Antidepressants for neuropathic pain // Cochrane Database Syst. Rev. 2007. Vol. 4: CD005454.
- Chong M. S., Bajwa Z. H. Diagnosis and treatment of neuropathic pain // J. Pain Symptom Manage. 2003. Bd. 25. (Suppl. 5). S. 4–11.
- Dworkin R. H., Backonja M., Rowbotham M. C. et al. Advances in neuropathic pain: diagnosis, mechanism, and treatment recommendation // Arch. Neurol. 2003. Vol. 60. P. 1524–1534.
- Finnerup N. B., Otto M., McQuay H. J. et al. Algorithm for neuropathic pain treatment: an evidence based proposal // Pain. 2005. Vol. 118, № 3. P. 289–305.
- Аметов А. С., Дадаева Е. Е., Строков И. А. с соавт. Актовегин в лечении заболеваний центральной и периферической нервной системы // Рус. мед. журн. 2007. Т. 15, № 24. С. 1824–1827.
- Луцкий И. С., Лютикова Л. В., Луцкий Е. И. Витамины группы B в неврологической практике // Междунар. неврол. журн. 2008. № 2. С. 89–93.
- Ba A. Metabolic and structural role of thiamine in nervous tissues // Cell. Mol. Neurobiol. 2008. Vol. 28. P. 923–931.
- Gibson G. E., Blass J. T. Thiamin-dependent processes and treatment strategies in neurodegeneration // Antioxid. Redox Signal. 2007. Vol. 9. P. 1605–1619.
- Wilson R. G., Davis R. E. Clinical chemistry of vitamin B6 // Adv. Clin. Chem. 1983. Vol. 23. P. 1–68.
- Solomon L. R. Disorders of cobalamin (vitamin B12) metabolism: emerging concept in patophysiology, diagnosis and treatment // Blood Rev. 2007. Vol. 21. P. 113–130.
- Тригеминальная невралгия. Интернет-обзор // Междунар. неврол. журн. 2010. № 2 (32). С. 103–104.
- Wiffen P. J., McQuay H. J., Moore R. A. Carbamazepine for acute and chronic pain. Cochrane Database Syst. Rev. 2005. Vol. 3: CD005451.
- Richter R. W., Portenoy R., Sharma U. et al. Relief of diabetic peripheral neuropathy with pregabalin: a randomised placebo-controlled trial // J. Pain. 2005. Vol. 6. P. 253–260.
- Кукушкин М. Л. Неврогенная (Невропатическая боль) // Междунар. неврол. журн. 2007. № 2 (12). С. 141–145.
- Sindrup S. H., Jensen T. S. Pharmacotherapy of trigeminal neuralgia // Clin. J. Pain. 2002. Vol. 18. P. 22–27.
- Jorns T. P., Zakrzewska J. M. Evidence-based approach to the medical management of trigeminal neuralgia // Br. J. Neurosurg. 2007. Vol. 21. P. 253–61.
- Gronseth G., Cruccu G., Alksne J. et al. Practice parameter: the diagnostic evaluation and treatment of trigeminal neuralgia (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the European Federation of Neurological Societies // Neurology. 2008. Vol. 71. P. 1183–1190.
- Jensen T. S. Anticonvulsants in neuropathic pain: rationale and clinical evidence // European Journal of Pain. 2002. Vol. 6 (Suppl. A). P. 61–68.
- Zakrzewska J. M., Chaudhry Z., Nurmikko T. J. et al. Lamotrigine (lamictal) in refractory trigeminal neuralgia: results from a double-blind placebo controlled crossover trial // Pain. 1997. Vol. 73. P. 223–230.
- Fromm G. H., Terrence C. F. Comparison of L-baclofen and racemic baclofen in trigeminal neuralgia // Neurology. 1987. Vol. 37. P. 1725–1728.
- Камчатов П. В. Невропатическая боль: проблемы и решения // НейроNEWS. 2009. № 4. С. 45–47.
- Attal N., Cruccu G., Haanpaa M. et al. EFNS guidelines on pharmacological treatment of neuropathic pain // European Journal of Neurology. 2006. Vol. 13. P. 1153–1169.
- Cheshire W. Defining the role for gabapentin in the treatment of trigeminal neuralgia: a retrospective study // J. Pain. 2002. Vol. 3. P. 137–142.
- Obermann M., Yoon M. S., Sensen K. et al. Efficacy of pregabalin in the treatment of trigeminal neuralgia // Cephalalgia. 2008. Vol. 28. P. 174–181.
- Perez C., Navarro A., Saldana M. T. et al. Patient-reported outcomes in subjects with painful trigeminal neuralgia receiving pregabalin: evidence from medical practice in primary care settings // Cephalalgia. 2009. Vol. 29. P. 781–790.
- Edwards K. R., O’Connor J. T., Button J. Levetiracetam for the treatment of trigeminal neuralgia // Epilepsia. 2004. Vol. 45 (Suppl. 7). P. 306.
- Lukyanetz E. A., Shkryl V. M., Kostyuk P. G. Selective blockade of N-type calcium channels by levetiracetam // Epilepsia. 2002. Vol. 43. P. 9–18.
- Patsalos P. N. Pharmacokinetic profile of levetiracetam: toward ideal characteristics // Pharmacol. Ther. 2000. Vol. 85. P. 77–85.
- Brockmoller J., Thomsen T., Wittstock M. et al. Pharmacokinetics of levetiracetam in patients with moderate to severe liver cirrhosis (Child-Pugh classes A, B, and C): characterization by dynamic liver function tests // Clin. Pharmacol. Ther. 2005. Vol. 77. P. 529–541.
- Zakrzewska J. M. Consumer views on management of trigeminal neuralgia // Headache. 2001. Vol. 41. P. 369–376.
- Jorns T. P., Johnston A., Zakrzewska J. M. Pilot study to evaluate the efficacy and tolerability of levetiracetam (Keppra®) in treatment of patients with trigeminal neuralgia // European Journal of Neurology. 2009. Vol. 16. P. 740–744.
- Степанченко А. В., Шаров М. Н. Применение габапентина при лечении обострений невралгии тройничного нерва // Боль. 2005. Т. 3, № 8. С. 58–61.
- Braune S. Evidence-based pharmacotherapy of neuropathic pain syndromes // MMW Fortschr. Med. 2004. Vol. 146, № 50. P. 49–51.
- Cruccu G. Treatment of painful neuropathy // Curr. Opin. Neurol. 2007. Vol. 20, № 5. P. 531–535.
- Hall G. C., Carroll D., Parry D., McQuay H. J. Epidemiology and treatment of neuropathic pain: The UK primary care perspective // Pain. 2006. Vol. 122. P. 156–162.
- Janetta P. Trigeminal neuralgia: treatment bymicrovascular decompression // Neurosurgery/Eds. Wilkins R., Regachary S. New York: McGrawy-Hill, 1996. P. 3961–3968.
- Perez C., Galvez R., Huelbes S. et al. Validity and reliability of the Spanish version of the DN4 (Douleur Neuropathique 4 questions) questionnaire for differential diagnosis of pain syndromes associated to a neuropathic or somatic component // Health Qual Life Outcomes. 2007. Vol. 5. P. 66.
- Mullan S., Lichtor T. Percutaneous microcompression of the trigeminal ganglion for trigeminal neuralgia // J. Neurosurg. 1983. Vol. 59. P. 1007–1012.
- Hakanson S. Trigeminal neuralgia treated by the injection of glycerol into the trigeminal cistern // Neurosurgery. 1981. Vol. 9. P. 638–646.
- Sweet W. H., Wepsic J. G. Controlled thermocoagulation of trigeminal ganglion and root for differential destruction of pain fibers. Part I: trigeminal neuralgia // J. Neurosurg. 1974. Vol. 39. P. 143–156.
- Barker F. G., Jannetta P. J., Bissonette D. J. et al. The long-term outcome of microvascular decompression for trigeminal neuralgia // N. Engl. J. Med. 1996. Vol. 334. P. 1077–1083.
- Tyler-Kabara E. C., Kassam A. B., Horowitz M. H. et al. Predictors of outcome in surgically managed patients with typical and atypical trigeminal neuralgia: Comparison of results following microvascular decompression // J. Neurosurg. 2002. Vol. 96. P. 527–531.
- Jannetta P. J. Microsurgical management of trigeminal neuralgia // Arch. Neurol. 1985. Vol. 42. P. 800.
С. А. Гордеев*, доктор медицинских наук Л. Г. Турбина**, доктор медицинских наук, профессор А. А. Зусьман**, кандидат медицинских наук *Первый МГМУ им. И. М. Сеченова, **МОНИКИ им. М. Ф. Владимирского, Москва
Контактная информация об авторах для переписки
Домашние средства лечения
Перед тем как лечить невралгию тройничного нерва в домашних условиях, необходимо проконсультироваться с врачом, поскольку многие средства могут только усугубить ситуацию. Если специалист разрешит, допускается использовать и различные домашние рецепты.
По рекомендациям при невралгии тройничного нерва стоит употреблять внутрь или смазывать пораженную сторону березовым соком. В сутки необходимо пить 4-5 стаканов. Облегчить боль поможет нагретая гречка, сложенная в хлопчатобумажную ткань. Компресс делают 2 раза в день, выдерживая его на месте воспаления вплоть до остывания. В домашних условиях полезно выполнять массаж больной области: растирать, поглаживать и слегка разминать место воспаления.
Мифы и опасные заблуждения в лечении
Ввиду того, что невралгия не влияет на общее состояние организма, многие пациенты откладывают посещение врача и лечение тройничного нерва. На самом деле это неверный подход, поскольку болезнь может привести к параличу и парезу мышц. Кроме того, она оказывает значительное воздействие на психологические и социальные аспекты жизни.
Не менее важен тот факт, что обезболивающие препараты при невралгии тройничного нерва дают только временный эффект. Со временем могут перестать действовать и противосудорожные препараты, поскольку к ним развивается привыкание. Поэтому нельзя злоупотреблять лекарственными средствами. Они лишь снимают симптомы невралгии, а ее причину может выявить только квалифицированный специалист.
Профилактика
Специфической профилактики против невралгии не существует. Врачи лишь рекомендуют по максимум исключить воздействие на организм тех факторов риска, которые могут привести к воспалению нерва. Чтобы этого избежать, необходимо не допускать переохлаждения лица, особенно летом при использовании вентиляторов и кондиционеров. Важно проводить закаливание, меньше беспокоиться, чтобы снизить влияние стрессов. Также обязательно должно проводиться лечение основных заболеваний, которые являются факторами риска невралгии.